结节性硬化症伴梗阻性脑积水1例报道
陈梦萦 展淑琴△ 车 璐 曹军霞 巩付华 郑少微
西安交通大学第二附属医院神经内科,陕西 西安 710004
基金项目:国家自然科学基金项目(No.81070999);中央高校基本科研业务费专项资金资助(西安交通大学,No.xjj2014153,No.2009-95);社会发展科技攻关项目(No.2016SF-020);西安交通大学第二附属医院人才培养专项科研基金科技骨干项目[No.RC (GG)201109]
【摘要】 目的 探讨结节性硬化症(tuberous sclerosis comlex,TSC)伴梗阻性脑积水的临床特点、影像学表现、病理学改变、鉴别诊断及治疗。 方法 回顾性分析1例TSC伴梗阻性脑积水患者的临床资料,并结合文献进行讨论。 结果 本例患者确诊为TSC,室管膜下巨细胞星形细胞瘤(subependymal giant cell astrocytoma,SEGA)待排。 结论 TSC可合并SEGA,并致梗阻性脑积水,手术切除肿瘤为有效的治疗方法,辅助应用 m TOR抑制剂可一定程度抑制肿瘤生长。
【关键词】 结节性硬化症;室管膜下巨细胞星形细胞瘤;癫痫发作;梗阻性脑积水;mTOR抑制剂
【中图分类号】 R593 【文献标识码】 D 【文章编号】 1673-5110(2018)01-0091-04 DOI:10.12083/SYSJ.2018.01.023
结节性硬化症(tuberous sclerosis comlex,TSC)是一种罕见的常染色体显性遗传病,也可见散发病例,可以累及脑、肺、心、肾脏等全身多个器官。室管膜下巨细胞星形细胞瘤(subependy-mal giant cell astrocytoma,SEGA) 是一种较罕见的神经上皮组织肿瘤,是TSC特征性病变之一,也是其主要致死性病因之一。本研究对1例TSC合并SEGA待排患者的临床资料进行分析,并系统复习相关文献。早期识别该病的典型临床表现和影像学特征,对于治疗和预后意义重大。
1 临床资料
患者 女,18岁,发作性意识不清、四肢抽搐18 a,视力下降2个月。出生8个月后开始出现发作性意识不清、四肢抽搐,呈全面性强直-阵挛性发作,服用各种抗癫痫药物,发作频率仍然增多,每次发作时间延长,现服用“托吡酯、癫痫宁、化风丹”等药物。1岁时面部双颊出现红色丘疹。智能减退,无法完成初中学业,退学。生于甘肃陇南,父母体健,弟弟妹妹体健。否认家族性遗传病史。
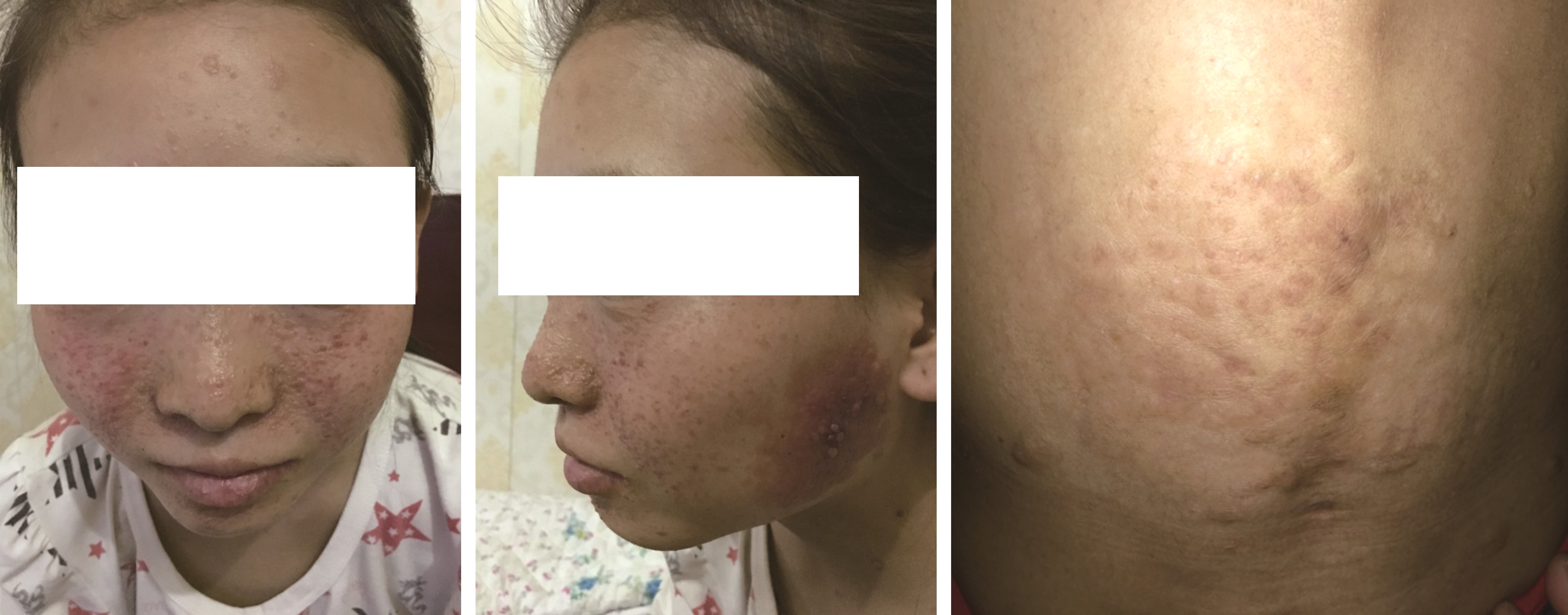
检查:发育迟缓,智力低下,体型偏瘦,面部鼻翼、双颊蝶形分布的红色丘疹、结节,质硬(纤维血管瘤,图1、2)。腰骶部不规则增厚并稍高起的表面起皱的软斑块(鲨鱼皮样斑块,图3)。眼科检查示视乳头水肿。
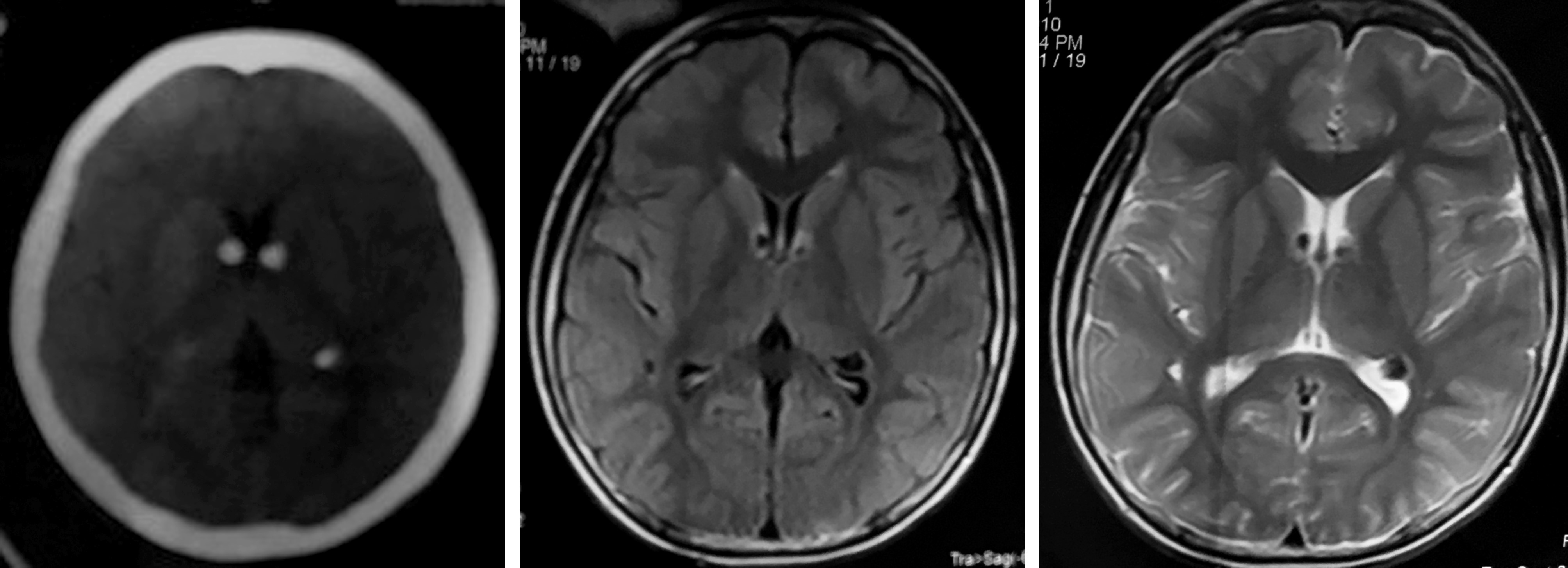
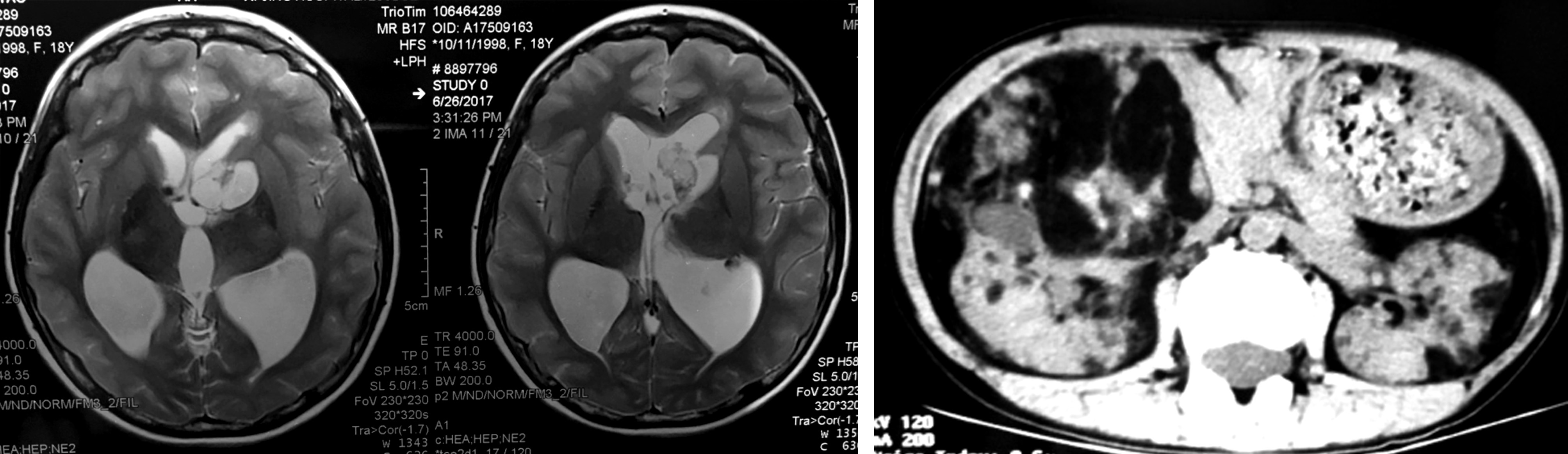
辅助检查:2010年头颅MRI及CT示:双侧脑室内、皮质及皮质下多发结节影伴钙化(图 4~6)。2017年头颅MRI示双侧侧脑室壁多发结节样短T2信号影,左侧室间孔区不规则占位,大小约1.2 cm×1.6 cm×1.8 cm,T1WI 呈低信号,T2WI呈稍高信号,室管膜下巨细胞瘤待排,幕上脑室扩张积水(图7)。眼球及眼眶MRI平扫未见异常。胸部CT平扫未见异常。肾动脉及肾脏CT平扫示:双肾多发错构瘤及胸腰椎骨质改变,符合结节性硬化症表现;肝内多发小血管瘤(图8)。
图1 面部纤维血管瘤 图2 面部纤维血管瘤 图3 腰骶部鲨鱼皮样斑块
图4 CT 平扫双侧脑室内多发结节影伴钙化“烛泪征” 图5 MRIT1WI双侧脑室内多发结节影 图6 MRIT2WI双侧脑室内多发结节影
图7 左侧室间孔区不规则占位,大小约 1.2cm×1.6cm×1.8cm,T2 稍高信号影,幕上脑室扩张积水 图8 双肾多发错构瘤
2 讨论
TSC是胚胎发育早期细胞分化、增殖和迁移异常所致的先天性疾病,可累及各个胚层,表现为皮肤、内脏、中枢神经系统的错构瘤。脑部是最常受累的部位,可表现为皮质结节、脑白质异常、室管膜下结节(subependymal nodule,SEN)、SEGA四种病变[1]。SEGA发生率为1.7%~14%,肿瘤组织学上起源于室管膜巨大星形细胞,多位于室间孔附近,病理上多为偏良性的肿瘤,生长缓慢。SEGA患者有较长的生存期,10 a生存率约为80%。
TSC 合并 SEGA 的临床表现为:(1) 典型的Vogt 三联征,包括面部皮肤血管瘤、癫痫发作和智能减退。皮肤损害特征性表现为对称蝶形分布于口鼻三角区的淡红色或红褐色丘疹,坚硬蜡样,随年龄增长逐渐融合成片,约20%患者10岁以后可见腰骶部鲨鱼皮样斑块,呈灰褐色、粗糙,略高于皮肤,为结蹄组织增生所致。70%~90%的患者出现癫痫发作,可自婴儿痉挛症开始,随之转化成部分性发作或全面强直-阵挛发作。智能减退多呈进行性加重,常伴有情绪不稳、行为幼稚、易冲动等精神症状。现多认为皮质结节是癫痫发作及智力障碍的原因,结节的数目和位置与脑功能障碍的程度相关。(2)颅内高压症状,当SEGA阻塞室间孔及三脑室时,会引起梗阻性脑积水,患者出现头痛、呕吐及视乳头水肿[2]。(3)眼部病变:50%患者有视网膜和视神经胶质瘤,最特征性的表现为视网膜晶体瘤,通常无症状,易误诊为视盘水肿或视神经炎[3],国内报道极少,较为罕见。(4)肾脏病变:错构瘤、囊肿较为常见,TSC患者的肾错构瘤多发且常累及双侧,肿瘤一般较大,出现症状的可能性明显高于一般的肾错构瘤[4]。(5)肝脏病变:TSC伴肝脏血管平滑肌脂肪瘤较少见,可以单发,也可以多发,多为青年人,无肝功能损害。骨骼病变:大多数表现为颅骨、椎骨、骨盆及长骨等处的结节性骨质硬化灶,部分为指(趾)骨囊肿[6]。TSC可以影响全身各器官系统和也可发生于各种族群体[5]。本例患者有典型的面部纤维血管瘤及腰骶部鲨鱼皮样斑块,18 a癫痫发作病史,智能减退未能完成学业,脑积水严重,有明显的颅内高压症状,视乳头水肿,视力下降;双肾多发错构瘤;肝内多发小血管瘤;胸腰椎骨质改变;与上述临床特点相符,符合2012年国际结节性硬化症共识会议制定的TSC诊断标准[6],堪称教科书级经典。
TSC 患者 CT检查可见侧脑室壁散在分布的室管膜下结节,为等或稍高密度,常见内部钙化(烛泪征)。MRI可发现白质病灶、皮质及皮质下结节。SEGA 患者 MRI常表现为侧脑室不规则团块状信号,T1WI 呈低信号或等信号,T2WI呈等信号或高信号,可有多房囊变,瘤内钙化点表现为空信号,增强扫描有显著均匀强化。本例患者2010年头颅MRI及CT示:双侧脑室内、皮质及皮质下多发结节影伴钙化。2017年头颅MRI示幕上脑室扩张积水,双侧侧脑室壁多发结节样短T2信号影,左侧室间孔区不规则占位,大小约1.2 cm×1.6 cm×1.8 cm,T1WI 呈低信号,T2WI呈稍高信号,符合SEGA患者的影像学表现。
病理学上SEGA瘤体呈类圆形结节状,大小不一,切面呈灰白色,质地较硬,可有坏死、液化或囊性变。肿瘤由较多的胞浆丰富的嗜伊红细胞组成,细胞异形性不大。本例患者为我科门诊患者,随访得知由于经济原因,患者未进行手术,故无法取得病理学资料。
SEGA 应与侧脑室室管膜下瘤和脉络丛乳头状瘤及SEN等相鉴别。侧脑室室管膜下瘤多见于中、老年龄组,增强后病变强化不明显,DWI 呈低信号;脉络丛乳头状瘤在婴儿更常见,MRI 呈T1低信号,T2高信号,增强扫描大多有显著强化,临床可表现为交通性脑积水。SEGA 与 SEN 位于侧脑室内,均是结节性硬化症的主要特征之一,但 只 有 一 小 部 分SEN会 继 续 生 长 形 成SEGA。当肿瘤逐渐增大并出现颅内高压甚至脑积水时,SEGA 诊断较明确。有文献报告,根据连续影像学资料观察显示SEGA的平均生长速度为每年3.44 mm(肿瘤直径)[7]。当 SEN 直径 >10 mm,位于室间孔附近且钙化不全时,很可能形成 SEGA[6,8]。本例患者7年前头颅MRI考虑为SEN,此次MRI示左侧室间孔区占位,大小约1.2 cm×1.6 cm×1.8 cm,梗阻性脑积水明显,应考虑形成SEGA。
TSC 合并SEGA 主要采用手术治疗,有两种手术入路:经额叶皮质入路和经胼胝体-穹窿间入路。若肿瘤明显偏向一侧,则经该侧额叶皮质入路较为合适;而对于双侧肿瘤、肿瘤基底附着于透明隔、肿瘤较大侵及第三脑室时,推荐选择胼胝体入路;而肿瘤局限于一侧脑室且体积较小时,则两种入路均可[9]。近年相关文献多认为,经胼胝体-穹窿间入路可更有效地开通双侧侧脑室并有利于脑室与蛛网膜下腔的交通,故可避免再行脑室分流术。KOTULSKA等[10]对 57 例TSC 并 SEGA 患者随访发现,肿瘤直径越大,术后并发症发生风险越高,当肿瘤直径<2 cm 时手术相对安全,肿瘤完全切除者可治愈。本例患者肿瘤直径<2 cm,已出现脑积水症状,且视力下降明显,应积极采取手术治疗,推荐经胼胝体-穹窿间入路,手术相对安全。
当肿瘤>3 cm、双侧、多发或复发时,手术风险成倍升高,对于这些不适用手术治疗者,mTOR抑制剂作为新型治疗药物引起广泛关注。mTOR抑制剂能够靶向抑制mTOR通路的活性,从而控制细胞周期蛋白合成,纠正其过度活化,从病因上治疗,对肿瘤生长起到抑制作用。mTOR抑制剂对TSC合并的肺、肾等脏器病变均有较好的治疗效果。目前mTOR抑制剂雷帕霉素和雷帕霉素的衍生物依维莫司已被FDA批准用于治疗伴有SEGA的成人和儿童,但并不能根除肿瘤。同时,也可用于伴有肾血管平滑肌脂肪瘤但无需立即手术的成人,JOHN等[11]认为雷帕霉素较经皮栓塞能更好地防止出血、复发,保护肾功能。
总之,TSC是一种累及全身多系统的常染色体遗传病,临床表现复杂多变,应提高临床医师对TSC并SEGA的认识;加强对TSC患儿家长的宣教,定期随访,以早期发现SEGA,尽早手术治疗。
3 参考文献
[1] 阴鲁鑫,王胥,沈志刚,等.结节性硬化症合并室管膜下巨细胞星形细胞瘤[J].临床神经外科杂志,2016,13(3):224-226.
[2] 李春德,罗世祺,马振宇,等.结节性硬化合并室管膜下巨细胞星形细胞瘤的诊断和治疗[J].中华医学杂志,2004,84(8):673-674.
[3] 张林妹,周渊峰,柴毅明,等.结节性硬化105例临床特征和基因型分析[J].中国循证儿科杂志,2016,11(3):219-222.
[4] BERNAUER TA,MIROWSKI G W,CALDEMEYER K S,et al.Tuberoussclerosis.Musculo-skeletaland visceralfindings[J].J Am Acad Dermatol,2001,45:450-452.
[5] DIMARIO F J Jr,SAHIN M,EBRAHIMI-FAKHARI D.Tuberous sderosis complx[J].Pediatr Clin North Am,2015,62(3):633-648.
[6] ROTH J,ROACH E S,BARTELS U,et al.Subependymal giant cell astrocytoma:diagnosis,screening,and treatment.Recommendations from the International Tuberous Sclerosis Complex Consensus Conference 2012[J].Pediatr Neurol,2013,49(6):439-444.
[7] CUCCIA V,ZUCCARO G,SOSA F,et al.Subependy-mal giant cell astrocytoma in children with tuberous sclerosis[J].Childs Nerv Syst,2003,19(4):232-243.
[8] 苏少波,杨学军,张建宁,等.合并结节性硬化复征的室管膜下巨细胞型星形细胞瘤(附9例报告)[J].中国现代神经疾病杂志,2007,8(7):322-326.
[9] 姜涛,张玉琪,甲戈,等.结节性硬化合并室管膜下巨细胞星形细胞瘤[J].中华神经外科杂志,2009,25(5):391-394.
[10] KOTULSKA K,BORKOWSKA J,ROSZKOWSKI M,et al.Surgi-cal treatment of subependymal giant cell astrocytoma in tuber-ous sclerosis complex patients[J].Pediatr Neurol,2014,50(4):307-312.
[11] BISSLER J J,KINGSWOOD J C.Optimal treatment of tuberous sclerosis complex associated renal angiomyolipomata:a systematic review[J].Ther Adv Urol,2016,8(4):279-290.
(收稿2017-09-05 修回2017-11-06)
本文编辑:关慧
本文引用信息:陈梦萦,展淑琴,车璐,曹军霞,巩付华,郑少微.结节性硬化症伴梗阻性脑积水1例报道[J].中国实用神经疾病杂志,2018,21(1):91-94.