p38MAPK在脑缺血后处理大鼠海马区的表达与意义
孙鸿雁 刘 宇
天津中医药大学第二附属医院,天津 300150
基金项目:天津市卫生计生委中西医合基金,编号:13085
【摘要】 目的 观察脑缺血后处理大鼠海马区神经元p38MAPK表达变化,探讨脑缺血后处理的脑保护机制。方法 将96只雄性SD 大鼠随机均分为假手术组(Sham组)、脑缺血组(IR组)、脑缺血后处理组(IpostC组)。Sham组只切开头部皮肤不电凝,分离颈总埋线不夹闭。IR组采用改良的Pulsinelli四血管闭塞(4-VO)法制作全脑缺血大鼠模型,缺血时间20 min;IpostC组于IR组恢复再灌注前给予再灌注15 s/缺血15 s,重复3次处理。每组又按恢复再灌注后6 h、24 h、48 h、72 h分为4个亚组(每个亚组8只大鼠)。应用光镜观察各组大鼠海马区神经元形态变化;免疫组织化学染色和Western Blot检测海马区磷酸化p38MAPK表达情况。结果 IR组大鼠海马区神经元结构损伤严重,各时间点神经元坏死率增加,神经元磷酸化p38MAPK表达增多,差异有统计学意义(P<0.05);与IR组比较,IpostC组大鼠海马区神经元结构损伤明显改善,各时间点神经元坏死率下降,神经元磷酸化p38MAPK表达明显增多,差异有统计学意义(P<0.05)。结论 脑缺血后处理对全脑缺血再灌注损伤具有保护作用,其机制可能与下调p38MAPK表达有关
【关键词】 p38MAPK;脑缺血再灌注损伤;脑缺血后处理;海马区;大鼠;脑保护
【中图分类号】 R-332 【文献标识码】 A 【文章编号】 1673-5110(2018)01-0007-05 DOI:10.12083/SYSJ.2018.01.002
Expression and significance of p38MAPK in hippocampus following cerebral ischemic postconditioning in rats
SUN Hongyan,LIU Yu
The Second Affiliated Hospital of Tianjin University of TCM,Tianjin 300150,China
【Abstract】 Objective To observe the expression change of p38MAPK in hippocampus neurons and investigate the brain protecting mechanism following cerebral ischemic postconditioning in rats.Methods 96 male SD rats were randomly divided into three groups:sham group,global cerebral ischemia group and cerebral ischemic postconditioning group.The rats in sham group received head skin cut,no electric coagulation and carotid separation with no embed wire clip.The model of cerebral ischemia was established by using improved pulsinelli four vessels block (4-VO),and the time of ischemia was 20 minutes.The rats in ischemic postconditioning group were treated with 3 times reperfusion(15s)/ischemia(15s) before reperfusion.Each group was divide into four subgroups (each with 8 rats) according to reperfusion after 6h,24h,48h and 72h.We used HE staining under light microscope to observe variation of neurons form and immunohistochemistry and Western blot to test the expression of p38MAPK.Results The neurons structure of the cerebral ischemia group was damaged,neuron necrosis rate and the expression of phosphorylated p38MAPK increased at each time point,the differences were statistically significant(P<0.05).Compared with cerebral ischemia group,the neurons structure in the cerebral ischemic postconditioning group were ameliorate damaged,neuron necrosis rate and the expression of phosphorylated p38MAPK were decreased at each time point,the difference was statistically significant(P<0.05).Conclusion Cerebral ischemic postconditioning have endogenous nerve protective effect in cerebral ischemia reperfusion injury,the mechanism may be related to the decrease of the expression of p38MAPK.
【Key words】 p38MAPK;Cerebral ischemia/reperfusion injury;Ischemic postconditioning;Hippocampus;Rats;Brain protection
脑缺血后处理(ischemic postconditioning,IPostC)指于缺血脑组织恢复再灌注前给予多次短暂的缺血/再灌注处理。研究已证实脑缺血后处理可以增强脑组织对缺血耐受性,减轻再灌注脑损伤,具有内源性保护作用[1]。但是脑缺血后处理的脑保护作用机制目前尚不明确。研究发现,全脑缺血大鼠模型中,缺血区神经元p38MAPK活性明显增强,神经元凋亡增加,指出p38MAPK参与全脑缺血再灌注损伤的过程[2]。本研究通过建立全脑缺血大鼠模型,观察脑缺血后处理后大鼠海马区神经元形态学变化及p38MAPK表达情况,探讨脑缺血后处理的脑保护作用机制,为临床治疗脑缺血再灌注损伤提供新的理论依据。
1 材料与方法
1.1 实验动物与分组 健康雄性SD大鼠96只,体质量300~350 g,购于北京维通利华实验动物中心。随机分为假手术组(Sham组)、脑缺血组(IR组)、缺血后处理组(IpostC组),每组32只。各组按恢复再灌注时间又分为6 h、24 h、48 h、72 h 4个时间亚组,每个时间点8只。
1.2 主要实验试剂与药品 兔抗P38(Tyrl82)多克隆抗体(北京博奥森生物技术有限公司);一抗稀释液(碧云天生物技术研究所);羊抗兔二抗工作液(北京博奥森生物技术有限公司);浓缩型DAB试剂盒(中杉金桥);BCA蛋白浓度测定试剂盒(碧云天生物技术研究所)。
1.3 模型制作与处理 按照改良的Pulsinelli四血管闭塞法制作全脑缺血大鼠模型,10%水合氯醛腹腔麻醉后,以枕后正中线切头部皮肤,逐层分离直至暴露第一颈椎椎状孔后,电凝双侧椎动脉;沿颈正中切开皮肤,逐层分离直至分离双侧颈总动脉(CCA)后埋线备用。均消毒后缝合切口,恢复24 h后夹闭双侧CCA 20 min。模型成功判定标准:大鼠昏迷、翻正反射消失、双侧瞳孔放大、眼睛颜色发白。Ipost C组大鼠恢复再灌注前给予短暂的缺血/再灌注处理,时间各15 s,重复3次。Sham组大鼠只切开头部皮肤不电凝,分离颈总埋线不夹闭。各组在恢复再灌注后6 h、24 h、48 h、72 h处死大鼠留取实验标本。
1.4 HE染色 切片常规脱蜡至水,经苏木精水溶液染色及1%盐酸乙醇分化后,水化返蓝30 min,0.5%伊红溶液复染,再经梯度酒精脱水二甲苯透明后由中性树胶固定封片。结果判定与计数:每个时间点随机选取4只大鼠,每只大鼠选取5张切片,光学显微镜(40×10)下随机观察5个不重叠视野。可见坏死神经元细胞核变形或消失,胞核深染,细胞排列疏松,间质水肿;存活神经元细胞核仁明显,排列整齐。采用Motic6.0数码医学图像分析系统计数海马区存活与坏死神经元细胞个数,坏死率为坏死神经元细胞与总神经元细胞之比,取其平均值进行统计分析。
1.5 免疫组织化学染色 采用标准SABC法,切片常规脱蜡至水,3%过氧化氢浸泡15 min阻断内源性过氧化物酶活性,经高压修复抗原后滴加磷酸化兔抗鼠p38MAPK抗体(工作浓度1:200),冰箱过夜后复温1 h,滴加二抗,37 ℃温箱孵育1 h,经DAB显色,苏木素复染,脱水透明后封固定片。缓冲液为PBS,时间5 min×3次。结果判定与计数:与HE染色共用大鼠,每只动物选取4张切片,光学显微镜(40×10)视野下,每张切片观察4个视野。P38MAPK阳性表达为胞核棕黄色,应用目镜网格测试系统,计数棕黄色细胞数,取均值进行统计分析。
1.6 免疫印迹检测 相应时间点处死大鼠,冰上操作分离海马组织,保存于EP管内,加入PIRA裂解液,考马斯亮蓝法蛋白质定量,样品制备,PADF转膜,脱脂奶粉封闭,加入抗体(p38MAPK稀释浓度为1:1 000),4 ℃冰箱过夜后室温恢复2 h,TBST洗膜,滴加二抗(TBST 1:2 000稀释),孵育1 h,ECL显色。Bio-Rad凝胶成像分析系统对条带进行曝光、显影和分析。以目的条带与内参β-actin的吸光度比值表示蛋白水平,进行半定量分析。
1.7 统计学分析 应用SPSS 17.0统计软件直接建立数据库进行统计分析,结果以均数±标准差(x±s) 表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
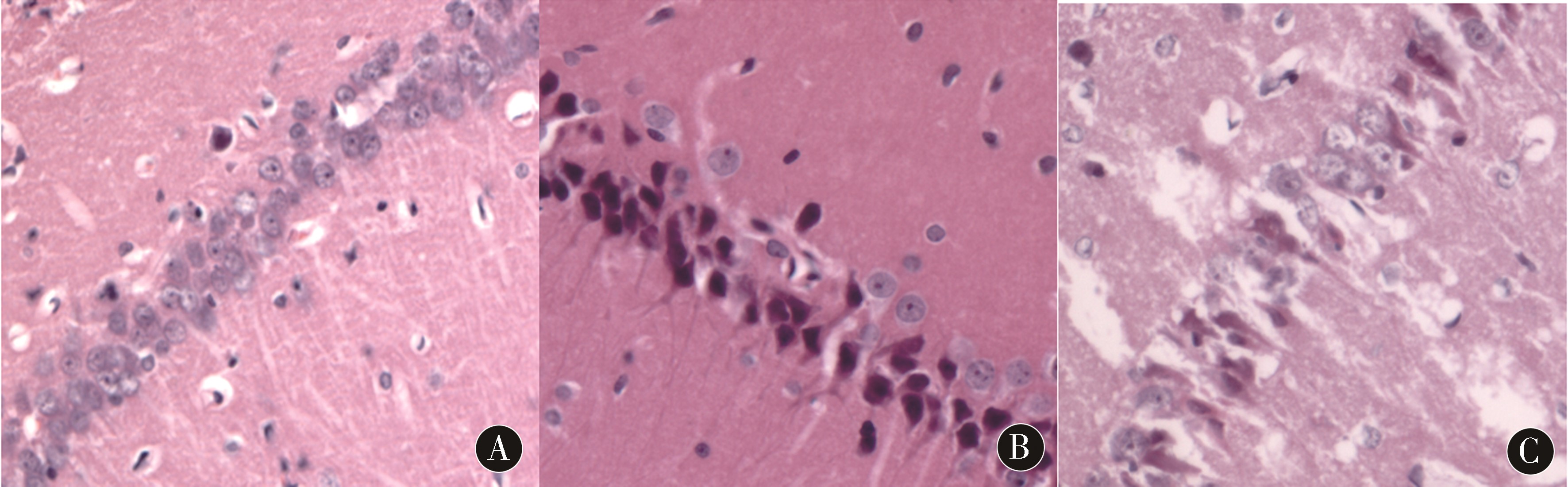
2.1 各组大鼠形态学观察 Sham组大鼠各个时间点海马区神经元细胞结构完整,排列紧密,细胞核形态正常,核仁清晰,染色均匀;IR组大鼠海马区神经细胞结构损伤严重,细胞核变形、固缩深染甚至消失,细胞排列结构疏松,随时间逐渐出现空泡结构。IpostC组大鼠海马区神经元细胞结构损伤较IR组明显改善,空泡结构减少。与Sham组比较,IR组各时间点神经元细胞坏死率明显增加,且随时间变化呈递增趋势,差异有统计学意义(P<0.05);与IR组比较,IpostC组神经元细胞坏死率明显下降,差异有统计学意义(P<0.05)。见表1、图1。
表1 各组大鼠海马区神经元细胞坏死率比较 (x±s)
| 组别 |
6 h |
24 h |
48 h |
72 h |
| Sham组 |
2.99±1.28 |
2.75±1.07 |
2.89±1.96 |
2.84±1.37 |
| IR组 |
28.90±1.22* |
33.24±2.13* |
39.14±1.97* |
45.14±1.26* |
| IpostC组 |
22.25±1.47*# |
27.35±1.62*# |
32.53±1.08*# |
39.39±1.64*# |
注:与Sham组比较,*P<0.05;与IR组比较,#P<0.05
Sham组 IR组 IpostC组
图1 各组大鼠24 h海马区神经元细胞HE染色结果(40×10)
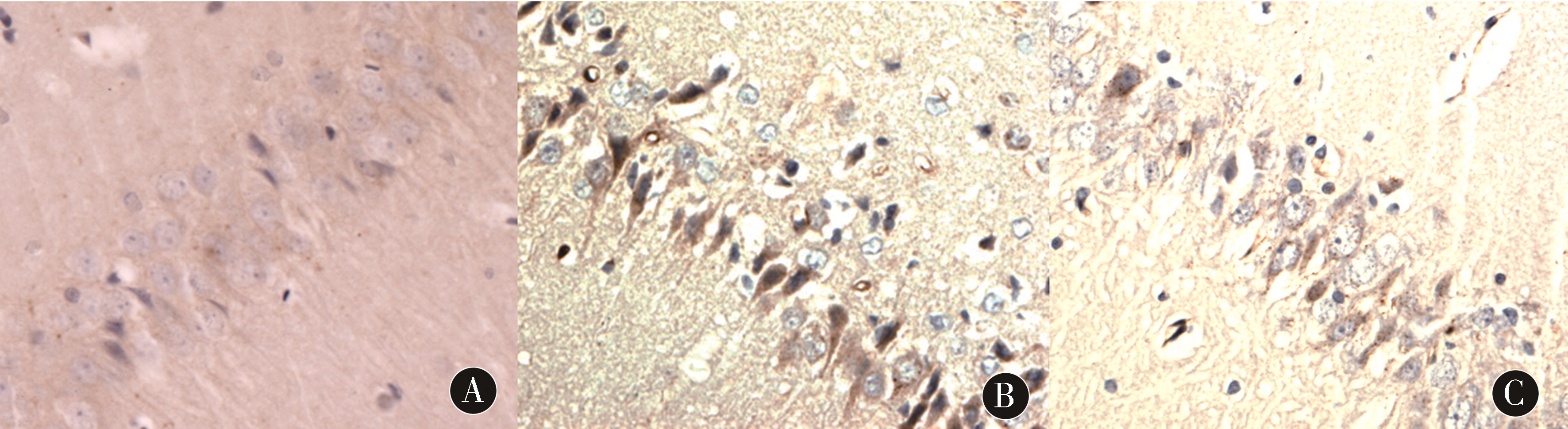
2.2 各组大鼠磷酸化p38MAPK免疫组化染色结果比较 Sham组见少量磷酸化p38MAP胞浆弱表达;与Sham组比较,IR组神经元细胞各时间点磷酸化p38MAPK阳性细胞表达明显增加,时间表达变化为:6 h阳性表达开始增加,24 h表达到高峰,48 h、72 h表达下降(P<0.05);与IR组比较,IpostC组神经元细胞各时间点磷酸化p38MAPK表达明显下降,差异有统计学意义(P<0.05)。见表2、图2。
表2 各组大鼠海马区磷酸化p38MAPK阳性细胞表达结果 (x±s)
| 组别 |
6 h |
24 h |
48 h |
72 h |
| Sham组 |
2.42±0.43 |
2.37±0.33 |
2.51±0.52 |
2.53±0.41 |
| IR组 |
18.27±1.43* |
26.74±2.09* |
15.34±1.42* |
12.36±1.61* |
| IpostC组 |
14.13±2.12*# |
20.30±1.56*# |
12.09±1.15*# |
8.47±0.95*# |
注:与Sham组比较,*P<0.05;与IR组比较,#P<0.05
Sham组 IR组 IpostC组
图2 各组大鼠24 h海马区磷酸化p38MAPK免疫组化染色结果(10×40)
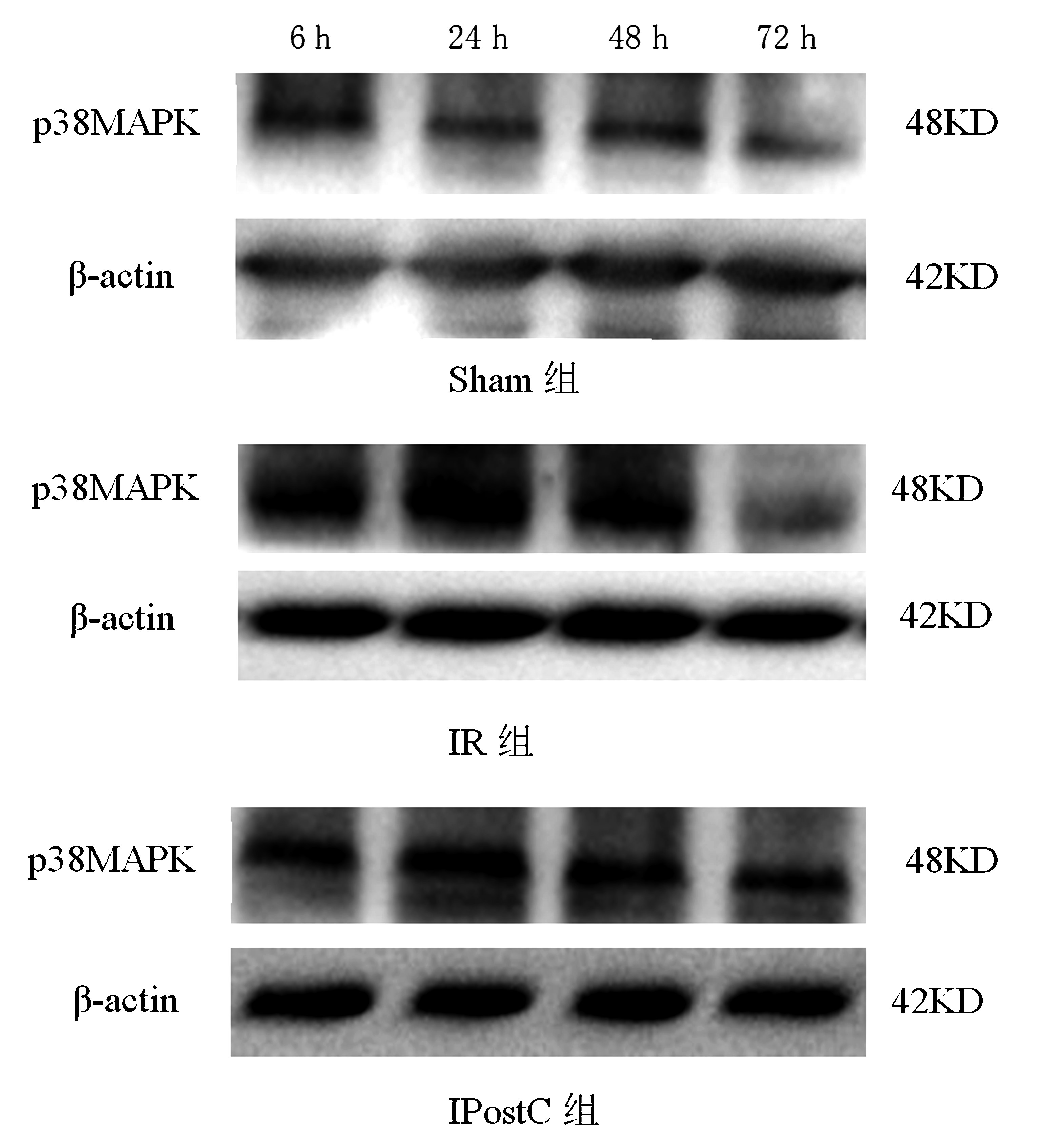
2.3 各组大鼠海马区磷酸化p38MAPK免疫印迹结果 以p38MAPK光密度值/β-actin光密度值表示p38MAPK蛋白的相对表达量。Sham组大鼠海马区各个时间点见少量磷酸化p38MAPK蛋白表达;与Sham组比较,IR组海马区各时间点磷酸化p38MAPK蛋白表达量明显增加,时间表达变化为6 h开始表达增加,24 h表达量最高,48 h、72 h表达逐渐下降(P<0.05);与IR组比较,IpostC组海马区各时间点磷酸化p38MAPK蛋白表达量明显下降,差异有统计学意义(P<0.05)。见表3、图3。
表3 各组大鼠海马区磷酸化p38MAPK蛋白免疫印迹结果 (x±s)
| 组别 |
6 h |
24 h |
48 h |
72 h |
| Sham组 |
0.21±0.04 |
0.22±0.03 |
0.21±0.02 |
0.21±0.04 |
| IR组 |
0.72±0.06* |
0.85±0.08* |
0.63±0.06* |
0.51±0.08* |
| IpostC组 |
0.43±0.05*# |
0.55±0.04*# |
0.38±0.07*# |
0.23±0.08*# |
注:与Sham组比较,*P<0.05;与IR组比较,#P<0.05
图3 Western blotting各组大鼠海马区磷酸化p38MAPK蛋白表达情况
3 讨论
众多实验研究已证实了缺血预处理(ischemic preconditioning,IPC)在局灶性和全球脑损伤的大鼠模型中的神经保护作用,并将IPC后的大脑保护划分为两个窗口[3]:一个是早期急性期,其保护作用在IPC后几分钟内存在,但几个小时后会消失;另一个是IPC发生大概24 h后期的保护窗口,在许多研究中被认为更有效,持续更长。随后的研究指出再灌注后短暂的缺血性脑缺血也是保护性的,这种现象被称为后处理(post conditionin,IPostC)[4-5]。由于IPostC的时间窗更易掌控,更具临床应用价值,所以其成为了过去十年学者研究的热点。与IPC类似,IPostC最初被证实为心肌缺血后的保护作用,并被应用到临床经皮冠状动脉介入治疗前干预[6]。随后研究证实IPostC同样具有脑保护作用[7-8]。2008年PIGNATARO等在大鼠永久性中动脉闭塞模型中证实脑缺血后处理能够减轻脑梗死面积,改善脑组织的神经功能障碍[9]。国内学者WANG等[10]指出10 min短暂全脑缺血后立即给予多次短暂再灌注/缺血处理,可以明显降低再灌注7 d后海马区以及顶叶皮脑质层神经元细胞的损伤和坏死。本研究中,与IR组比较,IPostC组大鼠海马区神经元细胞结构损伤明显改善,神经元细胞坏死率明显下降。进一步证实脑缺血后处理可以改善神经细胞功能,减少神经元细胞死亡,具有脑保护作用。
虽然脑缺血后处理的脑保护作用已经得到证实,但其内在机制尚不明确。众多研究认为脑缺血后处理主要通过激活或抑制相关自由基、凋亡因子及炎症因子等的表达,进而调控相应细胞信号通路,发挥缺血后处理的内源性神经保护作用[11]。在局灶性脑缺血或是短暂性全脑缺血发生后,如果脑组织缺血状态持续存在下去,神经元细胞最终将会走向坏死或凋亡,这其中涉及一系列基因的激活和其表达调控的改变[12]。p38丝裂原活化蛋白激酶(p38MAPK)属于MAPK超家族激酶,包括4个亚型:p38α、p38β、p38γ(SAPK3、ERK6)和p38δ(SAPK4),分布于全身各处组织细胞[13]。p38MAPK 也是细胞内信号转导通路中的重要信号分子,在细胞外多种应激原(细胞因子、生理应激等)的刺激下双膦酸化,参与机体生理、病理过程中如细胞生长、细胞凋亡、炎症及应激反应的调控等[14-15] 。近年来研究指出p38MAPK与脑缺血后神经元细胞的死亡密切相关。在全脑缺血再灌注损伤大鼠模型中发现,缺血区的神经元细胞内 p38活性明显增强,其下游Bcl-xl、Bax和AIF等凋亡基因过度表达,诱导神经元细胞凋亡,而应用p38MAPK活性抑制剂SB203580能明显减轻大脑局部缺血后的再灌注损伤[16]。国内学者李浩等[17]报道,大鼠局灶性脑缺血再灌注24 h,缺血区脑组织 p38的活性增强并伴随神经元的凋亡,表明p38在脑缺血后神经元凋亡的过程中起重要作。在本研究中采用免疫组化和WesternBlot法检测大鼠海马区磷酸化p38MAPK表达发现,IR组各时间点p38MAPK表达均较Sham组明显增加,其中在24 h表达最强,相应的HE染色结果显示,IR组各时间点神经元细胞坏死率较Sham组明显增加。说明p38MAPK参与脑缺血再灌注后神经元细胞死亡,与以往研究相一致。那么脑缺血后处理对p38MAPK表达有何影响,p38MAPK是否为脑缺血后处理脑保护作用潜在机制之一,目前尚无报道。本研究进一步检测了IPostC组大鼠海马区p38MAPK表达发现,与IR组比较,IPostC组各时间点p38MAPK表达明显下降,相应HE染色结果是IPostC组神经元细胞坏死率较IR组明显下降,提示脑缺血后处理可能通过降低海马区神经元细胞p38MAPK表达,减少神经元细胞死亡,发挥脑保护作用。脑缺血后处理作为一种新型的脑保护措施其研究还处于初始阶段,目前尚未应用于临床,有待我们进一步揭示脑缺血后处理的保护作用机制,以期早日应用于临床
4 参考文献
[1] YANG F,ZHANG X,SUN Y,et al.Ischemic postconditioning decreases cerebral edema and brain blood barrer disruption caused by relief of carotid stenosis in a rat model of cerebral hypoperfusion[J].PLoS One,2013,8(2):e57 869.
[2] PFFEILSCHIFTER W,CZECH B,HOFFMANN B,et al.Pyrrolidine dithiocarbamate activates p38MAPK and protects brain endothelial cells from apoptosis:a mechanism for the protective effect in stroke[J].Neurochem Res,2015,35(3):1 391-1 401.
[3] DURUKAN A,TATLISUMAK T.Preconditioning-induced ischemic tolerance:a window into endogenous gearing for cerebroprotection[J].Exp Transl Stroke Med,2010,2(1):2-9.
[4] ZHAO H,REN C,CHEN X,SHEN J.From rapid to delayed and remote postconditioning:the evolving concept of ischemic postconditioning in brain ischemia[J].Curr Drug Targets,2012,13(2):173-87.
[5] CAO Q F,QU M J,YANG W Q,et al.Ischemia postconditioning preventing lung ischemia-reperfusioninjury[J].Gene 2015,554:120-124.
[6] LASKEY W K.Brief repetitive balloon occlusions enhance reperfusion during percutaneous coronary intervention for acute myocardial infarction:a pilot study[J].Catheter Cardiovase Interv,2015,65(3):361-366.
[7] YUAN Y,GUO Q,YE Z,et al.Ischemic postcondi-tioning protects brain from ischem/reperfusion injury by attenuating endoplasmic reticulum stress- induced apoptosis through PI3K- Akt pathway[J].Brain Res,2011,13(67):85-93.
[8] ZHAO H,SAPOLSKY R M,STEINBERG G K.Interrupting reperfusion as a stroke therapy:ischemic postconditioning reduces infarct size after focal ischemia in rats[J].J Cereb Blood Flow Metab,2006,26(9):1 114-1 121.
[9] PIGNATARO G,MELLER R,INOUE K,et al.In vivo and in vitrocharacterization of a novel neuroprotective strategy for stroke:ischemic postconditioning[J].J CerebBlood Flow Metab,2008,28(5):232-241.
[10] WANG J Y,SHEN J,GAO Q,et al.Ischemic posteonditioning protects againstglobal cerebral isehemia/reperfusion induced injuryin rats[J].Stroke,2008,39(3):983-990.
[11] KONG Y,ROGERS M R,QIN X.Effective neuroprotection by ischemic postconditioning is associated with a decreased expression of RGMa and inflammation mediators in ischemic rats[J].Neurochem Res,2013,38:815-825.
[12] JIANG X J,SHI E Y,YOSHIKI N,et al.Postconditioning,a Series of BriefInterruptionsof EarlyReperfusion,Prevents Neurologic Injury After Spinal Cord Ischemia[J].Ann Surg,2016,244(1):148-153.
[13] ROY CHOUDHURY G,RYOU M G,et al.Involve-ment of P38 MAPK in reactive astrongliosis induced by ischemic stroke[J].Brain Res,2014,1551:45-58.
[14] YANG Y M,PARK W H.p38 inhibitor enhances growth inhibition and death in gallic acid-treated endothelial cells[J].Int J Mol Med,2010,26:295-300.
[15] ZHUANG Q Y,LIU J,HAN J H,et al.Functions and Mechanisms of the p38 MAP Kinase Pathway[J].Chinese Journal of Cell Biology,2013,35(2):123-133.
[16] PIAO C S,KIM J B,HAN P L,et al.Administration of the p38 MAPK inhibitor SB203580 affords brain protection with a wide therapeutic window against focal ischemic insult[J].J Neurosci Res,2003,73(4):537-544.
[17] 李浩,张多斌,吴岚,等.丹参酮IIA对脑缺血再灌注损伤大鼠磷酸化P38MAPK和 MMP-9表达及细胞凋亡的影响[J].中风与神经疾病杂志,2013,30(4):229-233.
(收稿2017-04-11 修回2017-12-06)
本文编辑:张喜民
本文引用信息:孙鸿雁,刘宇.p38MAPK在脑缺血后处理大鼠海马区的表达与意义[J].中国实用神经疾病杂志,2018,21(1):7-11.