目的 观察局灶性脑缺血大鼠IgG、MMP-2、occludin mRNA的动态变化,探讨阿托伐他汀对其的影响。方法 选用雄性SD大鼠108只,随机分为假手术组、模型组、治疗组,采用左侧大脑中动脉栓塞法制备局灶性脑缺血模型,以术后1、3、7 d为观察时间点。治疗组给予阿托伐他汀4 mg/(kg·d)灌胃,其余2组在相应时间给予等量生理盐水灌胃。观察各组大鼠IgG、MMP-2、occludin mRNA在各时间点的动态变化,评估血脑屏障变化情况。免疫组化法检测IgG、MMP-2,RT-PCR检测occlu
阿托伐他汀对局灶性脑缺血大鼠MMP-2 occludin mRNA的影响
杨会杰1) 张 娟2) 夏 昱1) 孙 环1) 孟祥光1)
1)郑州市第七人民医院,河南 郑州 450000 2)河南省人民医院,河南 郑州 450000
基金项目:中国博士后科学基金第56批面上资助项目,编号:2014M562001
作者简介:杨会杰(1981-),研究生,主治医师。研究方向:缺血性脑血管疾病。Email:444865828 @qq.com
【摘要】 目的 观察局灶性脑缺血大鼠IgG、MMP-2、occludin mRNA的动态变化,探讨阿托伐他汀对其的影响。方法 选用雄性SD大鼠108只,随机分为假手术组、模型组、治疗组,采用左侧大脑中动脉栓塞法制备局灶性脑缺血模型,以术后1、3、7 d为观察时间点。治疗组给予阿托伐他汀4 mg/(kg·d)灌胃,其余2组在相应时间给予等量生理盐水灌胃。观察各组大鼠IgG、MMP-2、occludin mRNA在各时间点的动态变化,评估血脑屏障变化情况。免疫组化法检测IgG、MMP-2,RT-PCR检测occludin mRNA。结果 与假手术组相比,模型组和治疗组在各时间点IgG、MMP-2增加,而occludin mRNA表达减少,均在第3天达峰,且差异有统计学意义(P<0.05)。与模型组相比,治疗组在各时间点IgG、MMP-2降低,而occludin mRNA表达增加,且差异有统计学意义(P<0.05)。结论 局灶性脑缺血大鼠血脑屏障通透性增加,在第3天最严重;阿托伐他汀可能通过抑制MMP-2活性,提高occludin mRNA表达,降低血脑屏障通透性,起到脑保护作用。
【关键词】 阿托伐他汀;局灶性脑缺血;血脑屏障;MMP-2;occludin mRNA
【中图分类号】 R-332 【文献标识码】 A 【文章编号】 1673-5110(2018)03-0243-04 DOI:10.12083/SYSJ.2018.03.063
Impact of atorvastat on MMP-2 and occludin mRNA in focal cerebral ischemia rats
YANG Huijie1),ZHANG Juan2),XIA Yu1),SUN Huan1),MENG Xiangguang1)
1)The Seventh People's Hospital of Zhengzhou,Zhengzhou 450000,China;2)Henan Provincial People's Hospital,Zhengzhou 450000,China
【Abstract】 Objective To observe the changes of IgG,MMP-2,occludin mRNA,and to investigate the impact of atorvastatin on IgG,MMP-2,occludin mRNA of focal cerebral ischemia rats.Methods One hundred and eight male SD rats were randomly divided into sham operation group,model group and treatment group,the focal cerebral ischemia model was induced by left middle cerebral artery occlusion,the observing time was 1d,3d,7d after operation.The treatment group received a gavage of atorvastatin 4mg/(kg·d),others were given the same amount of normal saline at corresponding time.The changes of IgG,MMP-2,occludin mRNA in each group were observed at each observing time to assess the changes in the blood-brain barrier.The expression of IgG,MMP-2 was analyzed by immunohistochemistry,the expression of occludin mRNA was analyzed by RT-PCR.Results Compared with the sham operation group,IgG,MMP-2 in both model group and treatment group increased at each observing time,but occludin mRNA expression decreased at each observing time,all of them reached the peak at 3d,the differences were all statistically significant (P<0.05).Compared with the model group,IgG,MMP-2 of treatment group decreased at each observing time,but occludin mRNA expression increased at each observing time,the differences were all statistically significant (P<0.05).Conclusion The permeability of blood-brain barrier in focal cerebral ischemia rats was increased,and reached the peak at 3d;atorvastatin can inhibit the activity of MMP-2,and increase the expression of occludin mRNA to reduce the permeability of blood-brain barrier and protect brain tissue.
【Key words】 Atorvastatin;Focal cerebral ischemia;Blood-brain barrier;Occludin mRNA;MMP-2
急性缺血性脑卒中(acute ischemic stroke,AIS)是神经科常见病,占脑卒中总发病率80%左右,常常导致患者偏瘫、失语、认知功能障碍、精神障碍等严重不良事件,因此尽早开通闭塞血管、恢复血流是治疗的关键。溶栓是首选治疗,但临床中真正受益者不足3%[1]。绝大多数患者发展成局灶性脑缺血,不仅造成神经细胞坏死、凋亡、自噬,而且使血脑屏障(blood-brain barrier,BBB)破坏,进而导致脑水肿、颅内压增高、炎症介质渗出,甚至脑出血,加重脑组织损伤。IgG是血清中一种免疫球蛋白,脑脊液中含量极微,因分子量大无法通过正常BBB,一旦BBB破坏,IgG等一些大分子物质可顺利通过,故通过测IgG渗出量可反应BBB破坏程度[2]。目前研究证实,BBB破坏与MMP-2、occludin等分子变化密切相关,但尚不清楚阿托伐他汀在AIS中是否可通过影响MMP-2、occludin mRNA等分子结构保护BBB。鉴于此,本实验通过建立局灶性脑缺血模型,观察IgG、MMP-2、occludin mRNA的动态变化,并探讨阿托伐他汀对其的影响。
1 材料与方法
1.1 主要材料与试剂 雄性SD大鼠108只,体质量(300±20)g,购自河南省实验动物中心(合格证:SCXK(豫)2010-0002);阿托伐他汀钙片(辉瑞制药有限公司,许可证号:H20051407);OD 值测量仪器(Merinton SMA4000);羊抗兔IgG抗体(美国Santacruz公司);RT-PCR试剂盒(北京Transgene公司)等。
1.2 方法
1.2.1 分组:将大鼠随机分为3组,即假手术组、模型组、治疗组,每组36只,各组设3个观察时间点:1 d、3 d、7 d,各个时间点12只。
1.2.2 大脑中动脉闭塞模型制备:实验前6 h禁食、2 h禁水。参照乐婷等[3]的线栓法制备左侧大脑中动脉闭塞法(middle cerebral artery occlusion,MCAO)模型,清醒后按Longa 5分[4]进行评分,1~3分为成功模型。假手术组只分离,不结扎,不插线。
1.2.3 给药:术后3 h,治疗组给予阿托伐他汀4 mg/(kg·d)灌胃(阿托伐他汀用5 mL生理盐水溶解),持续给药到相应观察时间点;假手术组和模型组在相应时间点给予等量生理盐水灌胃。
1.2.4 标本采集及保存:每组大鼠在相应时间点处死。随机取6只经心脏灌注40 g/L多聚甲醛后取脑,固定24 h后石蜡包埋保存,用于免疫组化检测;其余6只断头取脑,液氮迅速冷冻后移于-80 ℃冰箱保存,用于RT-PCR法检测。
1.3 检测指标
1.3.1 免疫组织化染色方法测IgG、MMP-2的表达:大鼠脑组织石蜡切片5 μm,二甲苯脱蜡,梯度乙醇水化,PBS冲洗3次,高压抗原修复5 min,自然冷却,PBS冲洗3次,滴加一抗50 μL,室温下孵育1 h;PBS冲洗3次,滴加二抗50 μL室温孵育15 min,用PBS冲洗3次,加DBA显色,苏木素复染,脱水,透明及封片。100倍镜下观察,400倍镜下计数阳性细胞数,采用Image Pro Plus 6.0(IPP)图像处理系统进行分析,测定平均光密度值(IOD)。
1.3.2 RT-PCR检测occludin mRNA的表达:按Trizol试剂说明提取脑组织总RNA,先用RNase H处理后,按照RT-PCR试剂盒说明合成cDNA以及PCR 扩增。Occludin引物序列上游为5' ATCTTTGTTACCAGCGTCAT 3',下游为5' CCTTTAATTCCTGCACCC 3'。以GAPDH作为内参照进行PCR 扩增,引物序列上游为5' TATCGGACGCCTGGTTAC 3',下游为5'ATGGGAGTTGCTGTTGA-AGT 3'。PCR 扩增条件为:94 ℃预变性2 min,1个循环;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,共35个循环;72 ℃总延伸6 min终止反应。PCR产物经20 g/L琼脂糖凝胶电泳鉴定,紫外线投射仪下拍照,用D-140图像记录分析系统进行分析,目的基因occludin mRNA的表达量以occludin的DNA条带和GAPDH的DNA条带灰度值的比值表示。
1.4 统计学分析 采用SPSS 17.0对数据进行录入和处理。计量资料以均数±标准差(x±s)表示,多组间多时间点比较采用析因方差分析,进一步分析分组单独效应,方差齐时两两比较采用LSD-t检验法,方差不齐时采用Dunnett’s T3法,检验水准。
2 结果
2.1 IgG免疫组化检测结果 根据析因方差分析结果显示,不同处理组间IgG免疫组化染色的IOD值差异有统计学意义(F=32 175.048,P<0.001);不同观察时间点间IgG免疫组化染色的IOD值差异有统计学意义(F=4 356.426,P<0.001);处理方法与作用时间之间存在交互作用(F=1 300.979,P<0.001)。进一步两两比较发现,在相同观察时间点,与假手术组相比,模型组和治疗组IgG免疫组化染色的IOD值均升高(P<0.001);与模型组相比,治疗组IgG免疫组化染色的IOD值均降低(P<0.001)。见表1。
表1 各时间点3组间IgG免疫组化染色的IOD值测定结果比较 (x±s)
| 组别 |
给药后1 d |
给药后3 d |
给药后7 d |
| 假手术组 |
10.085±0.751 |
10.193±0.721 |
10.000±0.635 |
| 模型组 |
110.480±1.254* |
140.200±1.627* |
73.082±1.058* |
| 治疗组 |
90.373±1.436*# |
95.365±1.341*# |
53.800±1.445*# |
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
2.2 MMP-2免疫组化测定结果 根据析因方差分析结果显示,不同处理组间MMP-2的差异有统计学意(F=20 892.815,P<0.001);不同观察时间点间MMP-2的差异有统计学意义(F=4 294.997,P<0.001);处理方法与作用时间之间存在交互作用(F=1 182.892,P<0.001)。进一步两两比较发现,在相同观察时间点,与假手术组相比,模型组和治疗组MMP-2均升高(P<0.001);与模型组相比,治疗组MMP-2均降低(P<0.001)。见表2。
表2 各时间点3组间MMP-2测定结果比较 (x±s)
| 组别 |
给药后1 d |
给药后3 d |
给药后7 d |
| 假手术组 |
34.695±1.510 |
35.875±1.322 |
34.748±1.437 |
| 模型组 |
130.822±2.106* |
184.832±1.071* |
100.093±1.648* |
| 治疗组 |
90.647±1.380*# |
133.427±1.474*# |
80.527±1.686*# |
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
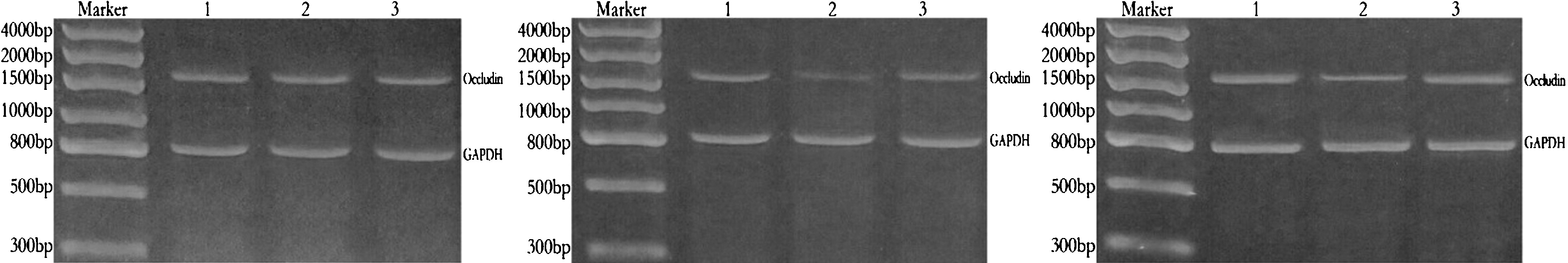
2.3 occludin mRNA的表达情况 根据析因方差分析结果显示,不同处理组间occludin mRNA表达的差异有统计学意义(F=8 330.538,P<0.001);不同观察时间点间occludin mRNA表达的差异有统计学意义(F=2 374.073,P<0.001);处理方法与作用时间之间存在交互作用(F=557.966,P<0.001)。进一步两两比较发现,在相同观察时间点,与假手术组相比,模型组和治疗组occludin mRNA表达均降低(P<0.001);与模型组相比,治疗组MMP-2均升高(P<0.001)。见表3、图1。
表3 各时间点3组间occludin mRNA表达比较 (x±s)
| 组别 |
给药后1 d |
给药后3 d |
给药后7 d |
| 假手术组 |
0.619±0.010 |
0.613±0.008 |
0.621±0.005 |
| 模型组 |
0.403±0.012* |
0.129±0.005* |
0.298±0.005* |
| 治疗组 |
0.498±0.009*# |
0.223±0.009*# |
0.407±0.006*# |
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
A:假手术组 B:模型组 C:治疗组
图1 不同时间点occludinmRNA表达结果 A:给药后1 d;B:给药后3 d;C:给药后7 d
3 讨论
AIS是一个多因素、多层次的复杂病理损伤过程,涉及氧自由基、钙超载、细胞因子、细胞凋亡、炎症反应、基质金属蛋白酶激活、线粒体损伤、BBB破坏等多重因素,造成脑组织损伤、神经功能障碍。在AIS中,BBB破坏出现早,持续时间长。研究发现[5],脑缺血60 min后BBB通透性增加,可持续4~5周[6],不仅造成病灶侧BBB破坏,还造成对侧BBB破坏[7]。BBB破坏常造成脑水肿、颅内压升高、炎症介质渗出,甚至脑出血,在疾病的发生、发展过程中,扮演着重要角色。因此,保护BBB是治疗AIS重要一环。
BBB是一道维持脑组织内环境稳定的高选择性、低渗性屏障。由两道屏障构成,第一道屏障是内皮细胞和内皮细胞连接,第二道屏障是基底膜;内皮细胞连接包括紧密连接和黏附连接,紧密连接位于细胞连接的上面,主要有跨膜蛋白、胞浆附着蛋白及细胞骨架蛋白共同组成,跨膜蛋白包括claudin、 occludin、JAM,跨膜蛋白的细胞内部分与胞浆附着蛋白相连,细胞外部分与相邻细胞的跨膜连接蛋白相互作用,而黏附连接位于细胞连结的基底面,对紧密连接的稳定起着重要的作用[8],内皮细胞及其间紧密连接是BBB的核心结构。Occludin、claudin-5是紧密连接的主要组成部分[9],occludin的分布和表达变化直接影响紧密连接功能及BBB通透性,是评价BBB功能的一项敏感指标[10]。在正常脑组织中,基质金属蛋白酶( matrix metallo proteinases,MMPs)以低表达量无活性的酶原形式存在,MMPs的活性与其转录、翻译、酶原激活、金属蛋白酶组织抑制因子(tissue inhibitors of metalloproteinases,TIMP)密切相关,并且MMPs与TIMPs维持着动态平衡。AIS可促进MMPs激活,特别是MMP-2和MMP-9激活,可降解BBB的内皮细胞连接和基底膜,加重脑组织损伤[11],MMP-2可直接降解occludin使BBB破坏。
本研究发现,与假手术组相比,模型组和治疗组的IgG渗出量随时间延长先升高后降低,在第3天达到高峰,且差异有统计学意义(P<0.05),提示脑缺血后BBB通透性增加且在第3天最严重;MMP-2随缺血时间延长先升高后降低,而occludin mRNA表达随缺血时间延长先减低后升高,均在第3天达峰,且差异有统计学意义(P<0.05)。MMP-2活性增加可直接破坏内皮细胞连接蛋白和基底膜,occludin mRNA表达减少是内皮细胞紧密连接进一步受损,故BBB损伤与MMP-2活性增加和occludin mRNA表达减少密切相关。
阿托伐他汀安全性高、耐受性好,是AIS的一线用药,除了调脂、稳定斑块外,还具有抗炎、促进血管再生、促进神经元再生、抗凋亡、抗自噬、抗自由基等多种脑保护作用。在脑缺血模型中,研究发现阿托伐他汀可抑制claudin-5蛋白降解保护BBB[12]。Lischper等[13]研究发现,MMP-2抑制剂可通过抑制MMP-2活性,阻止occludin蛋白降解保护BBB。但是,目前尚不清楚然阿托伐他汀是否通过影响MMP-2、occludin mRNA等分子结构保护BBB,鉴于此,本实验通过建立MCAO大鼠模型,观察阿托伐他汀对缺血后大鼠脑组织MMP-2、occludin mRNA的影响。结果显示,与模型组相比,治疗组IgG渗出量减少,且差异有统计学意义(P<0.05),提示阿托伐他汀具有保护BBB作用;MMP-2在脑缺血后各个时间点均减少,而occludin mRNA表达在各时间点均增多,且差异有统计学意义(P<0.05),提示阿托伐他汀可抑制MMP-2活性减少内皮细胞连接蛋白和基底膜破坏,促进occludin mRNA表达使内皮细胞紧密连接更加稳固。由此我们可认为阿托伐他汀可能通过抑制MMP-2活性,提高occludin mRNA表达减轻BBB破坏,减少水分子、炎症介质渗出,起到保护脑组织作用。
总之,本实验表明局灶性脑缺血可造成BBB破坏,并呈动态变化,表现在第3天最严重,与MMP-2活性增加、occludin mRNA表达减少密切相关。阿托伐他汀可通过抑制MMP-2活性,增加occludin mRNA表达,影响BBB的超微分子结构,起到脑保护作用,进一步阐明了阿托伐他汀保护BBB的相关分子机制。
4 参考文献
[1] 高峰.急性缺血性脑卒中血管内治疗中国专家共识[J].中国脑血管病杂志,2014,11(10):556-560.
[2] 崔云,张琳,袁芳.自由落体致大鼠脑损伤后血脑屏障变化的研究[J].中国康复理论与实践,2006,12(8):649-650.
[3] 乐婷,王金兰,刘宗文,等.阿托伐他汀对局灶性脑缺血大鼠脑组织血管新生的影响[J].中华神经医学杂志,2015,14(4):473-477.
[4] LONGA E Z,WEINSTEIN P R,CARLSON S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[5] LIU X B,WANG Z H,WANG P,et al.Green tea polyphenols alleviate early BBB damage during experimental focal cerebral ischemia through regulating tight junctions and PKCalpha signaling[J].BMC Complement Altern Med,2013,13(1):187-197.
[6] STRBIAN D,DURUKAN A,PITKONEN M,et al.The blood-brain barrier is continuously open for several weeks following transient focal cerebral ischemia[J].Neurosci-ence,2008,153(1):175-181.
[7] GARBUZOVA-DAVIS S,HALLER E,WILLIAMS S N,et al.Compromised blood-brain barrier competence in remote brain areas in ischemic stroke rats at the chronic stage[J].J Comp Neurol,2014,522(13):3 120-3 137.
[8] ABBOTT N J,PATABENDIGE A A,DOLMAN D E,et al.Structure and function of the blood-brain barrier[J].Neurobiol Dis,2010,37(1):13-25.
[9] COISNE C,ENGELHARDT B.Tight junctions in brain barriers during central nervous system inflammation[J].Antioxid Redox Signal,2011,15(5):1 285-1 303.
[10] JIAO H X,WANG Z H,LIU Y H,et al.Specific role of tight junction proteins claudin-5,occludin,and ZO-1 of the blood-brain barrier in a focal cerebral ischemic insult[J].J Mol Neurosci,2011,44(2):130-139.
[11] LAKHAN S E,KIRCHGESSNER A,TEPPER D,et al.Matrix metalloproteinases and blood-brain barrier disruption in acute ischemic stroke[J].Front Neurol,2013,4:32.
[12] CUI L L,ZHANG X J,YANG R,et al.Neuroprotec-tion of early and short-time applying atorvastatin in the acute phase of cerebral ischemia:Down-regulated 12/15-LOX,p38MAPK and cPLA2 expression,ameliorated BBB permeability[J].Brain Reseach,2010,1 325(1 325):164-173.
[13] LISCHPER M,BEUCK S,THANABALASUNDARAM G,et al.Metalloproteinase mediated occludin cleavage in the cerebral microcapillary endothelium under pathological conditions[J].Brain Res,2010,1 326(2):114-127.
(收稿2017-07-21 修回2017-12-15)
本文编辑:王喜梅
本文引用信息:杨会杰,张娟,夏昱,孙环,孟祥光.阿托伐他汀对局灶性脑缺血大鼠MMP-2 occludin mRNA的影响[J].中国实用神经疾病杂志,2018,21(3):243-246.