目的 研究硫辛酸对大鼠局灶性脑缺血再灌注损伤的保护作用,进一步探讨其机制。方法 54只雄性清洁SD大鼠按照随机原则平均分成3组:假手术组(18只)、脑缺血再灌注组(对照组 18只)、脑缺血再灌注+硫辛酸治疗组(治疗组 18只)。大鼠大脑中动脉局灶性缺血2 h(MCAO),再灌注24 h。治疗组在再灌注同时经颈外静脉给予硫辛酸20 mg/kg,假手术组和对照组给予相同体积的溶媒。采用TTC染色法检测大鼠脑组织梗死体积;采用RT-PCR法检测大鼠脑组织TNF-α的表达;采用TUNEL法检测大鼠脑组织凋亡细
硫辛酸对大鼠脑缺血再灌注损伤的神经保护作用
刘庆杰1) 王 伟2) 白宏英3)
1)永城市人民医院神经内科,河南 永城 476600 2)南阳医学高等专科学校,河南 南阳 473061 3)郑州大学第二附属医院神经内科,河南 郑州 450014
基金项目:河南省医学教育研究课题,编号:Wjlx2016152
作者简介:刘庆杰(1982-),男,硕士研究生,主治医师。研究方向:脑血管病研究。Email:lqj820@126.com
【摘要】 目的 研究硫辛酸对大鼠局灶性脑缺血再灌注损伤的保护作用,进一步探讨其机制。方法 54只雄性清洁SD大鼠按照随机原则平均分成3组:假手术组(18只)、脑缺血再灌注组(对照组 18只)、脑缺血再灌注+硫辛酸治疗组(治疗组 18只)。大鼠大脑中动脉局灶性缺血2 h(MCAO),再灌注24 h。治疗组在再灌注同时经颈外静脉给予硫辛酸20 mg/kg,假手术组和对照组给予相同体积的溶媒。采用TTC染色法检测大鼠脑组织梗死体积;采用RT-PCR法检测大鼠脑组织TNF-α的表达;采用TUNEL法检测大鼠脑组织凋亡细胞数。结果 与假手术组相比,对照组和治疗组大鼠脑组织梗死体积,TNF-α的表达和凋亡细胞数均明显增加(均P<0.05)。与对照组相比,治疗组大鼠脑组织梗死体积,TNF-α的表达以及凋亡细胞数均明显减少(均P<0.05)。结论 我们的研究结果表明,硫辛酸对大鼠脑缺血再灌注损伤具有保护作用,可能机制为减轻脑缺血再灌注引起的炎症反应和细胞凋亡。
【关键词】 硫辛酸;脑缺血再灌注;梗死体积;肿瘤坏死因子a;凋亡细胞
【中图分类号】 R-332 【文献标识码】 A 【文章编号】 1673-5110(2018)04-0357-04 DOI:10.12083/SYSJ.2018.04.091
Neuroprotective effects of lipoic acid against focal cerebral ischemia reperfusion injury in rats
LIU Qingjie1),WANG Wei2),BAI Hongying3)
1)Department of Neurology,the People's Hospital of Yongcheng City,Yongcheng 476600,China;2)Nanyang Medical College,Nanyang 473061,China;3)Department of Neurology,the Second Affiliated Hospital of Zhengzhou University,Zhengzhou 450014,China
【Abstract】 Objective To investigate the protective effect of lipoic acid on focal cerebral ischemia reperfusion-induced injury in rats and further exploring the underlying mechanisms.Methods Fifty-four male clean SD rats were divided into three groups by the random number method:sham operation group (SO group,n=18),cerebral ischemia-reperfusion group (I/R group,n=18),cerebral ischemia-reperfusion group plus lipoic acid treatment group (treatment group,n=18).Rats were subjected to 2h of transient middle cerebral artery occlusion (MCAO),followed by 24h of reperfusion.Lipoic acid (20 mg/kg) was administered in 18 animals (treatment group) through the external jugular vein immediately after reperfusion.An equivalent volume of vehicle was administered to 36 animals (SO group and I/R group).The infarct volume of animals was determined by the 2,3,5-triphenyltetrazolium chloride staining.The expression level of TNF-α was detected by RT-PCR and the apoptotsis was detected by TUNEL method.Results Compared to SO group,cerebral infarction area,neuronal apoptosis and cerebral TNF-α production were enhanced significantly in I/R and treatment group.Compared to I/R,lipoic acid reduced cerebral infarction area,neuronal apoptosis and cerebral TNF-α production.Conclusion Our results suggested that lipoic acid has protective effects against cerebral I/R injury in rats,which may be attributed to attenuating inflammation and apoptosis induced by cerebral ischemia.
【Key words】 Lipoic Acid;Ischemia-reperfusion;Infarct volume;TNF-α;Apoptosis
缺血性卒中是目前危害人类健康的主要疾病,在缺血性疾病的抢救和治疗期间,组织损伤已被证明不单由缺血本身引起的,而且包括血液供应恢复之后发生的进一步恶化,称为“缺血/再灌注”(I/R)损伤。这种病理过程涉及多种因素,包括氧化应激,炎症反应和细胞凋亡等多种病理生理过程。硫辛酸(LA)是一种硫醇类抗氧化剂,已被临床批准和广泛应用于糖尿病周围神经病变的治疗[1]。近年发现硫辛酸可作为心血管疾病,脂质异常的治疗药物选择[2]。在动物实验中其对组织的保护作用很大程度上归因于它的抗氧化性,然而,硫辛酸在组织损伤和保护信号转导过程中亦具有独特的调节作用,这些信号通路的作用在硫辛酸诱导的脑缺血再灌注损伤的保护尚不清楚。本研究旨在探讨硫辛酸是否具有保护大鼠脑缺血再灌注损伤的作用及其可能的机制。
1 材料与方法
1.1 材料
1.1.1 动物与分组:清洁级健康雄性SD大鼠 54只,体质量230~320 g,由郑州大学动物中心提供。随机分为假手术组、脑缺血再灌注组(对照组)、脑缺血再灌注+硫辛酸干预组(治疗组),每组18只。
1.1.2 主要仪器及试剂:RT-PCR图像分析系统(大连Jim-X Scientific D140);PCR Gene Amp system(美国 Applied Biosystems 2700);电泳仪(北京市六一仪器厂 DYY-6C);图像采集系统(德国Lecia 显微照相系统);硫辛酸(亚宝药业太原制药有限公司,国药准字号H20055869);TUNEL试剂盒(罗氏ZK-8005),PCR试剂盒(EasyTaq DNA Polymerase,北京全式金生物技术有限公司AP111-12),2.3.5-氯化三苯基四氮唑(TTC 鼎国生物科技公司),Rt试剂盒(Easy Script First-Strand cDNA Synthesis Super Mix,北京全式金生物技术有限公司AE301-02)。
1.2 方法
1.2.1 动物模型制作及处理:采用改良zea-Longa线栓法制作大鼠左侧大脑中动脉局灶缺血模型。大脑中动脉局灶性缺血2 h后将线栓抽至颈外动脉处并固定再灌注24 h,成功完成缺血再灌注模型制作。假手术组只分离颈总动脉、颈内动脉-颈外动脉和迷走神经不结扎不插线栓。于缺血2 h后应用5分法进行神经功能评分。0分:无神经功能缺损;1分:提起尾部对侧躯干或前肢弯曲,或者在垂直悬挂时不能延伸前爪;2分:爬行盘旋到对侧,但休息时姿势正常;3分:丧失正确的反射;4分:没有自发的运动活动。1~3分为造模成功,0分、4分大鼠剔除。治疗组于再灌注开始时给予硫辛酸20 mg/kg颈外静脉注射;假手术组及对照组用相同剂量的溶媒替代。
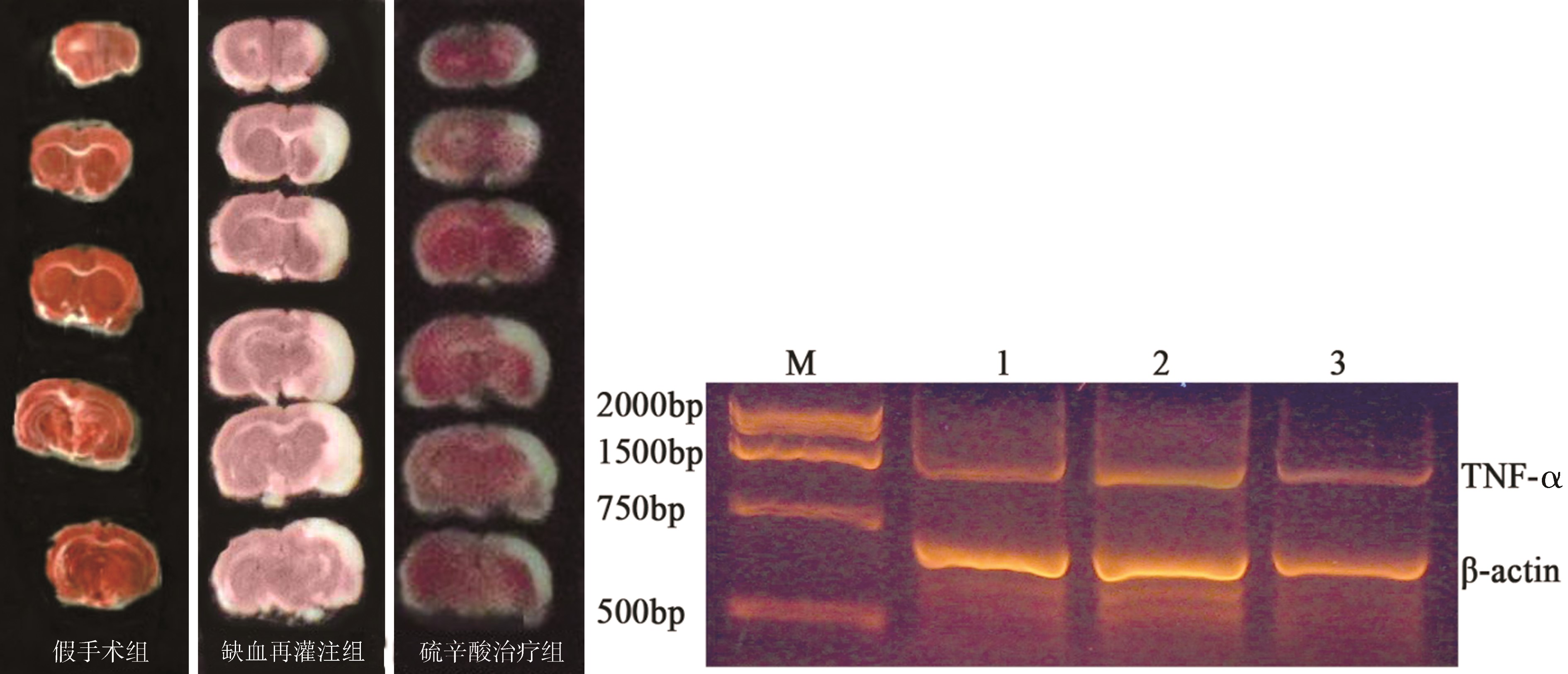
1.2.2 梗死体积检测:脑缺血2 h再灌注24 h,各组随机抽取6只大鼠采用过量水合氯醛深度麻醉实施安乐死。快速断头取脑,去除小脑,脑干等组织,冷生理盐水清洗,-20 ℃冰箱冷冻20 min,额极后1 mm开始行冠状切片,片厚2 mm,切片在含2% TTC PBS缓冲液中室温下孕育1 h,然后转移到4%多聚甲醛溶液中固定。同侧半球脑损伤的面积和梗死的体积应用Adobe Photoshop软件进行测量和计算。
1.2.3 TNF-α表达的检测:每组随机抽取6只大鼠,于冰块行快速断头取脑,液氮冷冻后保存于-80 ℃冰箱中备用,采用RT-PCR法检测大鼠病变侧脑组织TNF-α的表达。将大鼠缺血侧脑组织常规研磨提取总RNA。TNF-α大小为:1 315 bp,上游引物为:5' CCACGCTCTTCTGTCTACTG 3',下游引物为:5' AGCCTGGTCACCAAATCA 3',内参照β-actin大小为:568 bp,上游引物为:CCCATCTATGAGGGTTAC,下游引物为:GGAAGGTGGACAGTGAG。严格按照北京全式金生物技术有限公司RT-PCR和TRIZOL试剂盒说明书提供方法进行标准检测。扩增条件:94 ℃预变性2 min,1个循环;94 ℃变性30 s,反应35个循环;59 ℃退火35 s,72 ℃延伸2 min,共30个循环;72 ℃总延伸10 min。最后进行电泳测定,在紫外线投射仪下对跑好的电泳条带进行观察并照相,用图像记录仪和分析系统对所得条带进行光密度(OD)扫描分析,TNF-α的水平用TNF-α和DNAβ-actin的DNA条带灰度值比值来表示。
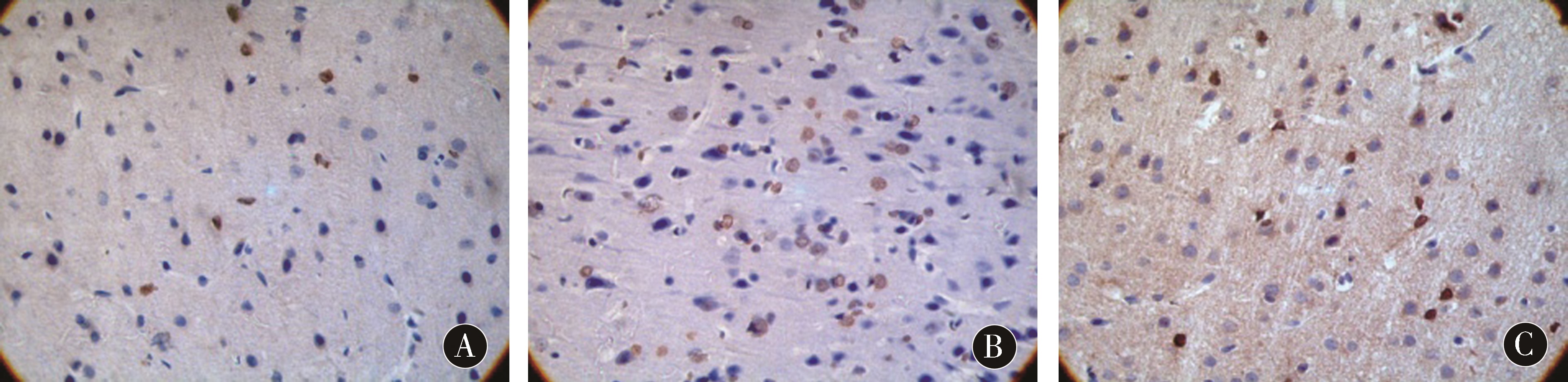
1.2.4 凋亡细胞数的检测:每组随机抽取6只大鼠,4%多聚甲醛灌注定形后,冰块上快速断头取脑,取病变侧视交叉后2~4 mm脑组织固定,石蜡包埋、冠状切片,制成厚2 μm的连续切片。严格依照TUNEL法凋亡检测试剂盒操作步骤进行操作,胞核染成棕褐色即为阳性细胞。每只大鼠随机选择梗死周围不连续切片5张,每张切片随机选择皮层5个不同的视野在400×镜下进行观察并计数、照相,随后求其平均数。
1.3 统计学分析 采用SPSS 17.0软件进行统计学分析,计量资料以均数±标准差(x±s)表示,2组间采用单因素方差分析进行比较,P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠脑组织梗死体积的比较 见表1与图1。与假手术组相比 对照组和治疗组大鼠脑组织梗死体积明显扩大(P<0.05)。与对照组相比,治疗组大鼠脑组织梗死体积明显缩小,差异具有统计学意义(P<0.05)。
2.2 各组大鼠脑组织TNF-α表达的比较 见表1与图2。与假手术组相比 对照组和治疗组大鼠脑组织TNF-α的表达明显升高(P<0.05)。与对照组相比,治疗组大鼠脑组织TNF-α的表达明显下降,差异具有统计学意义(P<0.05)。
2.3 各组大鼠脑组织凋亡细胞数的比较 见表1与图3。与假手术组相比 对照组和治疗组凋亡细胞数均明显增加(均P<0.05)。与对照组相比,治疗组大鼠脑组织凋亡细胞数均明显减少,差异具有统计学意义(P<0.05)。
表1 各组大鼠脑组织梗死体积、TNF-α表达及凋亡细胞数的比较 (x±s,n=6)
| 组别 |
n |
梗死体积(mm3) |
TNF-α/β-actin(OD值) |
凋亡细胞数(个/HP) |
| 假手术组 |
6 |
0 |
0.042 49±0.018 |
7.045±2.63 |
| 对照组 |
6 |
279.4±28.2* |
0.377 027±0.043* |
20.25±10.31* |
| 治疗组 |
6 |
218.3±26.3*△ |
0.132 569±0.031*△ |
10.05±3.86*△ |
注:与假手术组比较,*P<0.05;与对照组比较,△P<0.05
1.假手术组;2.缺血再灌注组;3.治疗组
图1 各组梗死体积的比较 图2 TNF-α mRN的表达
图3 各组脑组织Tunel阳性凋亡细胞数(×400) A:假手术组;B:缺血再灌注组;C:治疗组
3 讨论
硫辛酸 (LA)是一种存在于西兰花、菠菜和西红柿等食物中的硫醇类抗氧化剂。硫辛酸被视为线粒体α-酮酸脱氢酶复合体的补充,因此其在代谢中起着基础性作用[3]。硫辛酸及其还原型形式二氢硫辛酸(DHLA)由于具有较低的氧化还原电位被认为是理想的抗氧化剂,他们不但可以直接清除活性氧而且可以使内源性抗氧化剂谷胱甘肽、维生素E和维生素C再生。硫辛酸也有多样的分布形式,具有水溶性和脂溶性的特征,广泛分布于细胞膜、胞质和胞外空间。由于其具有安全,强大的抗氧化作用的性质,硫辛酸被广泛应用于糖尿病性周围神经病变的治疗并表现出良好的效果。由于其抗氧化特性,硫辛酸在氧化损伤治疗中具有潜在的意义[4]。然而,硫辛酸的有益作用似乎只是部分来源于它的抗氧化特性。最近有体外研究显示硫辛酸可减轻心肌缺血再灌注损伤,在心脏缺血再灌注动物实验中,硫辛酸预处理可以减少梗死面积,抑制细胞凋亡,更重要的是可以部分保存缺血再灌注衰竭心脏功能[5]。
脑缺血/再灌注损伤的病理和生理机制现在被认为与损伤级联相关,包括几种亚机制,如兴奋性氨基酸毒性,炎症,由氧化应激引起的脂质过氧化物反应和凋亡,这些过程之间的关系是相互影响的[6]。中枢神经系统受损后,神经递质可激活交感神经系统和下丘脑-垂体-肾上腺轴,这激活了对全身损伤的应激反应,释放炎症介质和趋化因子以加速炎症。黏附分子的释放产生炎症介质,导致局部缺血后继发性脑损伤。越来越多的研究表明,脑缺血/再灌注损伤的主要原因是炎症,其可以被认为是初次缺血后的继发性损伤[7]。各种细胞的激活和聚集在接收和传递炎症信号中起着不可或缺的作用。内源性介质(细胞因子和趋化因子)和循环中的白细胞均参与炎症反应。细胞因子在吸引白细胞作为趋化因子的有效诱导剂时发挥关键作用。因此,在炎症状态下细胞因子作为主要介质,趋化因子作为辅助介质吸引白细胞。此外,活化的星形胶质细胞和小胶质细胞产生细胞因子和趋化因子。这些分子似乎负责炎症细胞在损伤的脑组织中的聚集。TNF-α,IL-1β和IL-6是潜在的细胞因子,其引发炎症介质和炎症反应并诱导缺血再灌注损伤后其他细胞因子的表达[8]。通过对缺血侧脑组织TNF-α、IL-6和IL-1β水平升高的观察,被认为是缺血和再灌注损伤中组织损伤反应的一部分。因此,缺血性损伤后抑制炎症可能是治疗缺血性卒中的新策略。目前的研究结果表明,硫辛酸预处理可大大降低缺血侧脑组织TNF-α生产和中性粒细胞聚集,这是缺血再灌注后炎症反应的两个关键要素。因此,我们假设硫辛酸抑制缺血再灌注引起的炎症反应,从而有助于防止缺血再灌注损伤。在本研究中,我们的研究结果表明,硫辛酸通过降低TNF-α水平发挥抗炎作用,从而具有神经保护作用。
已有证据表明,凋亡对局灶性脑缺血后缺血半暗带的神经元死亡起关键作用[9-11],神经元是否以凋亡或坏死的形式存在取决于损伤的严重程度。众所周知,凋亡可以由氧化应激和线粒体功能障碍等因素触发。Caspase-3激活被认为是多重凋亡级联的最后一步和共同途径。脑缺血可能会增加其中一些触发因素,从而导致凋亡增加[12-13]。许多研究已经证明使用TUNEL测定法检测凋亡神经元的存在已被作为各种组织中缺氧或缺血性神经元死亡的指征。本研究中,我们检测到对照组大鼠缺血2 h再灌注24 h后TUNEL阳性细胞数量的增加。重要的是,硫辛酸治疗组TUNEL阳性细胞数量明显减少,此表明硫辛酸对凋亡存在抑制作用。
总之,硫辛酸对大鼠脑缺血再灌注具有保护作用,其可能机制为减轻炎症反应及抑制凋亡。
4 参考文献
[1] KALOGERIS T,BAINES C P,KRENZ M,et al.Cell Biology of Ischemia/Reperfusion Injury[J].Int Rev cell Mol Biol,2012,298:229-317.
[2] RICHARD M J,CONNELL B J,KHAN B V,et al.Cellular mechanisms by which lipoic acid confers protection during the early stages of cerebral ischemia:a possible role for calcium[J].Neurosci Res,2011,69(4):299-307.
[3] GHIBU S,RICHARD C,VERGELY C,et al.Antioxi-dant properties of an endogenous thiol:Alpha-lipoic acid,useful in the prevention of cardiovascular diseases[J].J Cardiovasc Pharmacol,2009,54(5):391-398.
[4] GOMES M B,NEGRATO C A.Alpha-lipoic acid as a pleiotro-pic compound with potential therapeutic use in diabetes and other chronic diseases[J].Diabetol Metab Syndr,2014,6(1):80-97.
[5] DENG C,SUN Z,TONG G,et al.α-Lipoic Acid Reduces Infarct Size and Preserves Cardiac Function in Rat Myocardial Ischemia/Reperfusion Injury through Activation of PI3K/Akt/Nrf2 Pathway[J].PLoS One,2013,8(3):e58371.
[6] LEWERENZ J,MAHER P.Chronic glutamate toxicity in neurodegenerative diseases—what is the evidence? [J].Front Neurosci,2015,9(12):469.
[7] XU D S,MIN H M,BAO C F,et al.Effect of procyanidins on TNF-α and HSP70 in cerebral tissue of rats with focal cerebral ischemia injury [J].Zhongfeng yu Shenj-ing Jibing Zazhi,2016,33(8):699-702.
[8] YASUDA Y,SHIMODA T,UNO K,et al.Temporal and sequential changes of glial cells and cytokine expression during neuronal degeneration after transient global ischemia in rats[J].J Neuroinflammation,2011,8(6):70-80.
[9] YUAN J.Neuroprotective strategies targeting apoptotic and necrotic cell death for stroke[J].Apoptosis,2009,14(4):469-477.
[10] MIZUMA A,YENARI M A.Anti-Inflammatory Tar-gets for the Treatment of Reperfusion Injury in Stroke[J].Frontiers in Neurology,2017,8(8):467.
[11] UYAR I S,AKPINAR M B,SAHIN V,et al.Alpha lipoic acid attenuates inflammatory response during extracorporeal circulation[J].Cardiovascular Journal of Africa,2013,24(8):322-326.
[12] NIIZUMA K,YOSHIOKA H,CHEN H,et al.Mitochondrial and apoptotic neuronal death signaling pathways in cerebral ischemia.[J].Biochim Biophys Acta,2010,1 802(1):92-99.
[13] TANAKA H,YOKOTA H,JOVER T,et al.Ischemic preconditioning:neuronal survival in the face of caspase-3 activation[J].Neurosci,2004,24(11):2 750-2 759.
(收稿2017-10-17 修回2018-01-22)
本文编辑:王喜梅
本文引用信息:刘庆杰,王伟,白宏英.硫辛酸对大鼠脑缺血再灌注损伤的神经保护作用[J].中国实用神经疾病杂志,2018,21(4):357-360.