目的 研究脑脊液谷氨酸水平与脑胶质瘤患者术后继发性癫痫发作的相关性。方法 收集190例脑胶质瘤患者外科手术后1个月内的脑脊液标本,根据患者术后是否有继发性癫痫发作将其分成为无癫痫发作组(n=117)和有癫痫发作组(n=73);使用高效液相层析法检测并比较2组患者脑脊液中谷氨酸的水平。结果 35%的胶质瘤患者术后仍有癫痫发作,其中96%的患者术前有癫痫发作。与胶质瘤术后继发癫痫发作风险相关的独立临床因素包括:术前有癫痫发作、年龄较轻、肿瘤位于颞叶和肿瘤中含少突胶质细胞成分。术后有癫痫发作的胶质瘤患者脑
脑胶质瘤患者术后脑脊液谷氨酸与继发性癫痫发作的关系
罗 凤 尤 宇 王继红 刘 辉 方 方 王旭颖
郑州大学附属肿瘤医院放疗科,河南 郑州 450008
基金项目:河南省医学科技攻关计划项目(编号:201503189)
作者简介:罗凤,Email:1305196652@qq.com
【摘要】 目的 研究脑脊液谷氨酸水平与脑胶质瘤患者术后继发性癫痫发作的相关性。方法 收集190例脑胶质瘤患者外科手术后1个月内的脑脊液标本,根据患者术后是否有继发性癫痫发作将其分成为无癫痫发作组(n=117)和有癫痫发作组(n=73);使用高效液相层析法检测并比较2组患者脑脊液中谷氨酸的水平。结果 35%的胶质瘤患者术后仍有癫痫发作,其中96%的患者术前有癫痫发作。与胶质瘤术后继发癫痫发作风险相关的独立临床因素包括:术前有癫痫发作、年龄较轻、肿瘤位于颞叶和肿瘤中含少突胶质细胞成分。术后有癫痫发作的胶质瘤患者脑脊液中谷氨酸水平明显高于无癫痫发作组(P<0.05)。Logistic回归分析发现:脑脊液中谷氨酸浓度的增加,年龄较轻、肿瘤位于颞叶和肿瘤中含少突胶质细胞成分,可以作为胶质瘤术后继发癫痫发作的独立预测因子。结论 脑脊液谷氨酸水平的增加与脑胶质瘤患者术后继发癫痫发作的风险密切相关,脑脊液谷氨酸水平或可成为预测胶质瘤术后癫痫发生的潜在指标。
【关键词】 谷氨酸;脑胶质瘤;脑脊液;癫痫;继发性
【中图分类号】 R730.264 【文献标识码】 A 【文章编号】 1673-5110(2018)20-2299-05 DOI:10.12083/SYSJ.2018.20.495
Relationship between postoperative cerebrospinal fluid glutamate and secondary seizures in patients with glioma
LUO Feng,YOU Yu,WANG Jihong,LIU Hui,FANG Fang,WANG Xuying
Department of Radiation Oncology,Affiliated Tumor Hospital,Zhengzhou University,Zhengzhou 450008,China
【Abstract】 Objective To study the correlation between cerebrospinal fluid glutamate levels and postoperative secondary seizures in patients with glioma.Methods Cerebrospinal fluid specimens were collected from 190 patients with glioma within 1 month after surgery,and were classified into non-seizure group (n=117) and seizure group (n=73)according to whether there was secondary seizure after surgery;High-performance liquid chromatography was used to detect and compare the levels of glutamate in the cerebrospinal fluid of the two groups of patients.Results 35% of glioma patients still have seizures after surgery,and 96% of them have seizures before surgery.Independent clinical factors associated with the risk of secondary seizures after glioma surgery include:preoperative seizures,younger age,tumors in temporal lobe and tumors containing oligodendrocyte components.The level of glutamate in the cerebrospinal fluid of patients with glioma after seizure was significantly higher than that in the non-seizure group (P<0.05).Logistic regression analysis found that the increase of glutamate concentration in cerebrospinal fluid,younger age,tumor in the temporal lobe and tumor containing oligodendrocyte components,can be used as an independent predictor of secondary seizure after glioma surgery.Conclusion The increase in cerebrospinal fluid glutamate levels is closely related to the risk of postoperative seizures in patients with gliomas.Cerebrospinal fluid glutamate levels may be a potential predictor of postoperative epileptic seizures in gliomas.
【Key words】 Glutamate;Glioma;Cerebrospinal fluid;Epilepsy;Secondary
脑胶质瘤是引起继发性癫痫发作常见的病因之一[1]。癫痫发作可作为脑胶质瘤最初的临床症状,随着肿瘤的进展,癫痫发作的次数及持续时间会相应增加,反复的癫痫发作给患者的心理及生理带来严重的负担[2]。外科手术是胶质瘤患者主要的治疗手段,随着胶质瘤的切除,部分患者癫痫发作终止,但是也有相当一部分患者术后经过一段时间又出现癫痫发作[3]。关于术后癫痫发作机制的研究较少,因此寻找能够预测胶质瘤术后继发癫痫发作的生物因子具有重要的临床意义。癫痫的发生通常具有一定的潜伏期,即癫痫形成期。在癫痫形成期,脑内已经发生一系列的生理病理变化,如果能在这一时间段内寻找监测提示癫痫发生的预测因子,并及早进行干预,则可明显终止或减轻癫痫发作,将长期以来癫痫的治疗以控制发作症状为主的治疗局面引导至以探索癫痫发生、预防为主的研究领域[4-5]。大量的研究发现胶质瘤发生发展过程中促进癫痫发生的病理生理改变包括:异常的神经元迁移[6-7];突触囊泡的改变[8-9];缝隙连接通道蛋白表达的增加导致的细胞间交换的增强[10];局部神经递质γ-氨基丁酸[11]、谷氨酸[12]及乳酸浓度[13]的改变导致的神经系统兴奋性及抑制性失衡等。之前有动物研究表明胶质细胞可以分泌大量的谷氨酸[14-15],肿瘤及其周围组织内谷氨酸的浓度明显高于正常组织[3]。兴奋性谷氨酸是中枢神经系统主要的兴奋性递质,其浓度的升高会激活突触神经元上的氨甲基磷酸(aminomethylphosphonic acid,aMPA)受体及N-甲基-D-天门冬氨酸(N-Methyl-D-aspartate,NMDA)受体,使局部神经元介导的兴奋性电流明显增加,进而产生同步化的癫痫样放电[16-17]。然而关于胶质瘤术后人脑脊液中谷氨酸浓度变化的研究较少,其是否与胶质瘤术后癫痫发作密切相关尚没有研究表明。本研究旨在研究脑胶质瘤术后脑脊液谷氨酸水平与继发性癫痫发作的相关性,探讨脑脊液谷氨酸水平是否可以作为预测胶质瘤术后继发性癫痫发作的重要生物标记物。
1 资料与方法
1.1 一般资料 选择2015-10—2017-07郑州大学附属肿瘤医院放疗科收治的190例脑胶质瘤术后1月内的患者为研究对象,根据患者术后是否有癫痫发作将其分为发作组(n=73)和无发作组(n=117)。出现1次以上的癫痫发作即认为有继发癫痫发作。排除标准:术前无癫痫发作的患者;非星形胶质细胞瘤,室管膜瘤,既往有脑损伤的患者;术后胶质瘤复发的患者;酒精及药物成瘾性患者;全身营养代谢障碍性疾病患者。发作组73例患者中35例术前有癫痫发作,经郑州大学伦理委员会讨论批准,向所有受试者说明本研究的性质、目的、收益及风险,遵从自愿原则,与每位受试者签订相关知情同意书。
1.2 研究方法 使用高效液相层析法检测脑脊液中谷氨酸的浓度,具体步骤如下:所有患者于上午行腰椎穿刺术取脑脊液,并将收集到的脑脊液立即存放于-80 ℃冰箱中冷冻保存待测。测试前将脑脊液冻融3次,1 000×g离心5 min,以除去脑脊液中蛋白,留取上清液用于衍生化。取脑脊液50 μL加0.5 mL硼酸缓冲液再加40 μL衍生试剂,室温下反应2 min后进样(所有的试剂和标准品均购买于美国Pierce公司),使用美国光谱物理公司HPLC系统进行分析。
1.3 统计学分析 使用统计软件SPSS 17.0进行统计学分析,采用χ2检验,P<0.05为差异有统计学意义。使用Logistic回归模型确定在发作组与未发作组单变量因素分析中有显著差异的解释变量作为预测因子。
2 结果
2.1 胶质瘤患者临床及统计学特征 发作组平均年龄较非发作组约年轻12岁。与无发作组相比,发作组肿瘤位于颞叶更常见(39.7% vs 25.6%)。肿瘤的病理分级与术后癫痫发作密切相关(表1)。低级别(WHOⅠ/Ⅱ)胶质瘤在发作组的百分比(30.1%)明显高于非发作组(13.7%,P<0.05)。术后是否发生癫痫发作与患者的性别、肿瘤位于哪侧大脑半球无关。见表1。
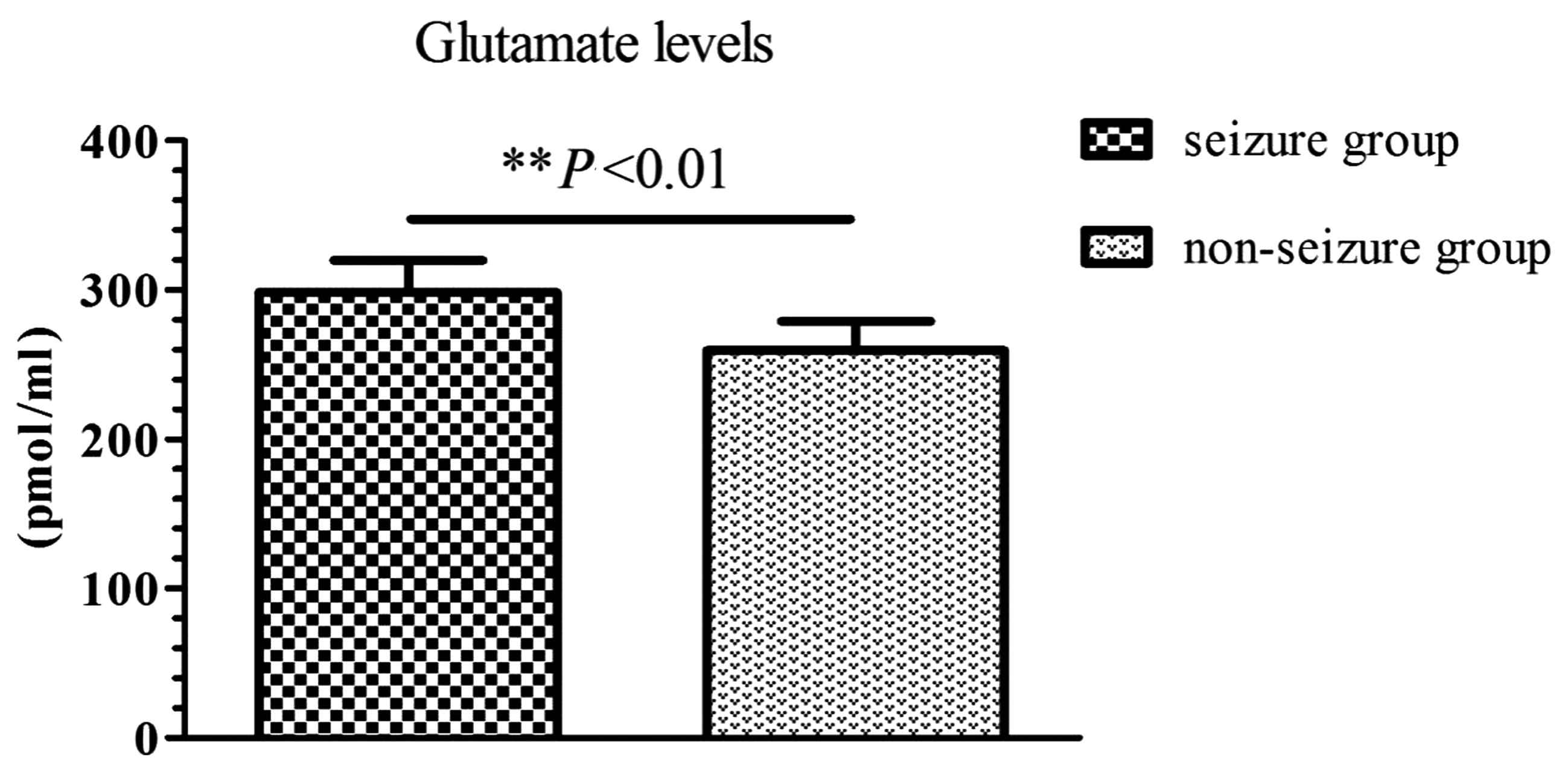
2.2 胶质瘤患者术后脑脊液谷氨酸水平 男性胶质瘤患者谷氨酸水平为(291.36±20.93)pmol/mL,女性胶质瘤患者(298.93±21.29)pmol/mL,差异无统计学意义(P>0.05)。发作组脑脊液谷氨酸水平明显高于无发作组(P<0.01)。见图1。
2.3 Logistic回归分析预测胶质瘤术后癫痫发作的危险因素 OR值随着年龄的增加而降低,胶质瘤位于颞叶与术后癫痫发作密切相关。以星形胶质细胞瘤(WHO Ⅱ)作为基准线,含少突胶质细胞成分的肿瘤术后癫痫发作的风险明显升高。CSF谷氨酸水平与胶质瘤术后癫痫发作明显相关。见表2。
图1 胶质瘤患者术后脑脊液谷氨酸水平
Figure 1 Cerebrospinal fluid glutamate levels in patients with glioma
表1 胶质瘤患者临床及统计学特征
Table 1 Clinical and statistical characteristics of glioma patients
| 临床资料 |
无发作组 |
发作组 |
95%置信区间 |
P值 |
| n |
117 |
73 |
|
|
| 年龄/岁 |
57.9 |
45.9 |
7.5~16.5 |
<0.001 |
| 男性 |
63(53.8) |
42(57.5) |
-17.7~10.7 |
0.66 |
| 病灶位于左侧 |
55(47.0) |
32(43.8) |
-11.2~17.2 |
0.77 |
| 病灶位置 |
0.045 |
|
|
|
| 额叶 |
57(48.7) |
36(49.3) |
|
|
| 颞叶 |
30(25.6) |
29(39.7) |
|
|
| 顶叶 |
23(19.7) |
7(9.6) |
|
|
| 枕叶 |
7(6.0) |
1(1.4) |
|
|
| 肿瘤类型 |
|
|
|
<0.001 |
| 星形胶质细胞瘤 |
8(6.8) |
5(6.8) |
|
|
| 少突胶质细胞瘤 |
8(6.8) |
17(23.3) |
|
|
| 间变性星形细胞瘤 |
7(6.0) |
20(27.4) |
|
|
| 多形性胶质母细胞瘤 |
94(80.3) |
31(42.5) |
|
|
| 低级别 |
16(13.7) |
22(30.1) |
-28.9~-4.6 |
0.01 |
| 高级别 |
101(86.3) |
51(69.9) |
|
|
表2 胶质瘤术后癫痫发作的危险因素分析
Table 2 Analysis of risk factors for postoperative seizures in glioma
| 解释变量 |
优势比(OR)估计量 |
95%置信区间 |
P值 |
| 肿瘤类型a |
|
|
|
| AA |
4.07 |
0.83~19.9 |
0.083 |
| GB |
0.79 |
0.18~3.4 |
0.74 |
| OL |
10.05 |
1.74~58.2 |
0.01 |
| 年龄(10 a) |
0.74 |
0.55~0.99 |
0.044 |
| 颞叶 |
3.76 |
1.60~8.81 |
0.002 |
| CSF谷氨酸 |
1.35 |
0.74~2.49 |
0.03 |
注:AA:间变型星形细胞瘤;GB:胶质母细胞瘤;OL:少突胶质细胞瘤或肿瘤含少突胶质细胞成分
3 讨论
本研究表明,胶质瘤术后癫痫发作组较无癫痫发作组脑脊液谷氨酸浓度明显升高,且Logistic回归分析显示脑脊液中谷氨酸浓度的增加,年龄较小、肿瘤位于颞叶以及肿瘤中含少突胶质细胞成分,与术后癫痫发作风险明显相关,这些可作为胶质瘤术后癫痫发作的独立预测因子。研究提示,年龄与胶质瘤继发癫痫发作的风险相关。之前的研究[3]认为,年轻的胶质瘤患者胶质瘤分化程度较低,更易继发癫痫发作,与本研究结果基本一致。此外,胶质瘤中含有少突胶质成分提示继发癫痫发作风险较高,这与之前的磁共振研究表明少突胶质细胞瘤比正常脑组织含谷氨酸浓度高[18-20]有关。脑胶质瘤是中枢神经系统引起继发癫痫发作最常见的原因[21-24],但是有相当一部分患者外科术后一段时间又出现癫痫发作,本研究表明,胶质瘤术后癫痫发作患者脑脊液谷氨酸水平明显上升,因而脑脊液谷氨酸可能作为癫痫发作的生物预测因子。谷氨酸是中枢神经系统兴奋性递质,之前有研究表明未接受手术治疗的胶质瘤患者肿瘤及瘤周组织谷氨酸浓度明显高于正常患者[15,25-29],这在某种程度上提示了谷氨酸与胶质瘤继发癫痫发作相关。动物研究[20,30-33]表明,导致谷氨酸浓度增加的主要原因是兴奋性氨基酸转运体1(excitatory amino acid transporter 1,EAAT1)和兴奋性氨基酸转运体2(excitatory aminoacid transporter 2,EAAT2) 的下调。由于肿瘤周围组织EAAT2的下调[21],异常分泌的谷氨酸不能被转运至细胞内,胶质细胞产生后的谷氨酸可释放至脑室[22],从而进入脑脊液中。
本次研究使用脑脊液作为标本,与脑组织相比,创伤小,脑脊液采集较易应用于临床,且可方便动态观察。因此,脑脊液生物标记物的研究具有较高的使用价值。检测脑脊液谷氨酸水平,若其在临床癫痫发作出现之前已明显升高,则可使用一系列降低谷氨酸效能的药物,如NMDA受体拮抗剂[15],柳氮磺吡啶,一种系统性 Xc-抑制剂[23]等。本研究提示,谷氨酸可能是胶质瘤术后预防性治疗癫痫发作的有效靶点,将癫痫发作从对症治疗提升至预防性治疗,从而大大降低癫痫发作给胶质瘤术后患者带来的危害。
4 参考文献
[1] MASCHIO M,DINAPOLI L,ZARABLA A,et al.Outcome and tolerability of topiramate in brain tumor associated epilepsy[J].J Neurooncol,2008,86(1):61-70.
[2] SEIDENBERG M,PULSIPHER D T,HERMANN B.Association of epilepsy and comorbid conditions[J].Fut Neurol,2009,4(5):663-668.
[3] BROGNA C,ROBLES S G,DUFFAU H.Brain tumors and epilepsy[J].Expert Review of Neurotherapeutics,2008,8(6):941.
[4] JACOBS M P,FISCHBACH G D,DAVIS M R,et al.Future directions for epilepsy research[J].Neurology,2001,57(9):1 536-1 542.
[5] KELLEY M S,JACOBS M P,LOWENSTEIN D H.The NINDS epilepsy research benchmarks[J].Epilepsia,2010,50(3):579-582.
[6] LEE M C,KANG J Y,SEOL M B,et al.Clinical features and epileptogenesis of dysembryoplastic neuroepithelial tumor[J].Childs Nerv Syst,2006,22(12):1 611-1 618.
[7] LEE M C,KIM G M,WOO Y J,et al.Pathogenic significance of neuronal migration disorders in temporal lobe epilepsy[J].Human Pathology,2001,32(6):643-648.
[8] PEREGO C,VANONI C,BOSSI M,et al.The GLT-1 and GLAST glutamate transporters are expressed on morphologically distinct astrocytes and regulated by neuronal activity in primary hippocampal cocultures[J].Journal of Neurochemistry,2010,75(3):1 076-1 084.
[9] ALONSO-NANCLARES L,DEFELIPE J.Vesicular glutamate transporter 1 immunostaining in the normal and epileptic human cerebral cortex[J].Neuroscience,2005,134(1):59-68.
[10] ARONICA E,GORTER J A,JANSEN G H,et al.Expression of connexin 43 and connexin 32 gap-junction proteins in epilepsy-associated brain tumors and in the perilesional epileptic cortex[J].Acta Neuropathologica,2001,101(5):449-459.
[11] RICHARDSON M P,HAMMERS A,BROOKS D J,et al.Benzodiazepine-GABA A,Receptor Binding Is Very Low in Dysembryoplastic Neuroepithelial Tumor:a PET Study[J].Epilepsia,2010,42(10):1 327-1 334.
[12] ARONICA E,YANKAYA B,JANSEN G H,et al.Ionotropic and metabotropic glutamate receptor protein expression in glioneuronal tumours from patients with intractable epilepsy[J].Neuropathology and Applied Neurobiology,2010,27(3):223-237.
[13] STEFAN H,FH L D S,LÖSCHER W,et al.Epileptogenesis and rational therapeutic strategies[J].Acta Neurologica Scandinavica,2010,113(3):139-155.
[14] MARCUS H J,CARPENTER K L H,PRICE S J,et al.In vivo assessment of high-grade glioma biochemistry using microdialysis:a study of energy-related molecules,growth factors and cytokines[J].J Neurooncol,2010,97(1):11-23.
[15] TAKANO T,LIN J H,ARCUINO G,et al.Glutamate release promotes growth of malignant gliomas[J].Nature Medicine,2001,7(9):1 010.
[16] 王新伟,赵智伟.MRS 在界定脑胶质瘤病理级别和病变范围中的诊断价值[J].中国实用神经疾病杂志,2017,20(4):83-85.
[17] CLARKE G,O'MAHONY S,MALONE G,et al.An isocratic high performance liquid chromatography method for the determination of GABA and glutamate in discrete regions of the rodent brain[J].J Neurosci Methods,2007,160(2):223-230.
[18] RIJPKEMA M,SCHUURING J,VAN DER MEULEN Y,et al.Characterization of oligodendrogliomas using short echo time 1H MR spectroscopic imaging[J].Nmr in Biomedicine,2003,16(1):12-18.
[19] 董丽妍,陈辰.德巴金在胶质瘤术后癫痫中的应用价值及相关护理体会[J].中国实用神经疾病杂志,2016,19(9):125-126.
[20] LIU Y C,LEE Y D,WANG H L,et al.Anesthesia-Induced Hypothermia Attenuates Early-Phase Blood-Brain Barrier Disruption but Not Infarct Volume following Cerebral Ischemia[J].PLoS One,2017,12(1):e0170682.
[21] ZSCHOCKE J,ALLRITZ C,ENGELE J,et al.DNA methylation dependent silencing of the human glutamate transporter EAAT2 gene in glial cells[J].Glia,2010,55(7):663-674.
[22] YE Z C,SONTHEIMER H.Glioma cells release excitotoxic concentrations of glutamate[J].Cancer Resea-rch,1999,59(17):4 383-4 391.
[23] BUCKINGHAM S C,CAMPBELL S L,HAAS B R,et al.Glutamate release by primary brain tumors induces epileptic activity[J].Nature Medicine,2011,17(10):1 269-1 274.
[24] WRIGHT E A,D'ESTERRE C D,MORRISON L B,et al.Absolute Cerebral Blood Flow Infarction Threshold for 3-Hour Ischemia Time Determined with CT Perfusion and 18F-FFMZ-PET Imaging in a Porcine Model of Cerebral Ischemia[J].PLoS One,2016,11(6):e0158157.
[25] THOMSEN C,DALBY NO.Roles of metabotropic glutamate receptor subtypes in modulation of pentylenetetrazole-induced seizure activity in mice[J].Neuropharmacology,1998,37(12):1 465.
[26] MERLIN L R.The ups and downs of hippocampal metabotropic glutamate receptors: ramifications for epileptogenesis and cognitive impairment following status epilepticus[J].Epilepsy Curr,2008,8(2):43-45.
[27] NGOMBA R T,SANTOLINI I,SALT T E,et al.Metabotropic glutamate receptors in the thalamocor-tical network:Strategic targets for the treatment of absence epilepsy[J].Epilepsia,2011,52(7):1 211-1 222.
[28] NAGARAJA R Y,GRECKSCH G,REYMANN K G,et al.Group I metabotropic glutamate receptors interfere in different ways with pentylenetetrazole seizures,kindling,and kindling-related learning deficits[J].Naunyn-Schmiedebergs Archives of Pharmacology,2004,370(1):26.
[29] PARSONS C G,DANYSZ W,QUACK G.Glutamate in CNS disorders as a target for drug development:an update[J].Drug News & Perspectives,1998,11(9):523-569.
[30] WONG M,ESS K C,UHLMANN E J,et al.Impaired glial glutamate transport in a mouse tuberous sclerosis epilepsy model[J].Annals of Neurology,2003,54(2):251-256.
[31] MOLDRICH R X,CHAPMAN A G,DE S G,et al.Glutamate metabotropic receptors as targets for drug therapy in epilepsy[J].European Journal of Pharmacology,2003,476(1):3-16.
[32] WADA K.Epilepsy and glutamate transporters:study of mice lacking a glutamate transporter and other recent advances[J].Tanpakushitsu Kakusan Koso,1998,43(3):244.
[33] ZENG L H,BERO A W,ZHANG B,et al.Modulation of astrocyte glutamate transporters decreases seizures in a mouse model of Tuberous Sclerosis Complex[J].Neurobiol Diseas,2010,37(3):764-771.
(收稿2018-01-16 修回2018-09-20)
本文责编:王喜梅
本文引用信息:罗凤,尤宇,王继红,刘辉,方方,王旭颖.脑胶质瘤患者术后脑脊液谷氨酸与继发性癫痫发作的关系[J].中国实用神经疾病杂志,2018,21(20):2299-2303.DOI:10.12083/SYSJ.2018.20.495
Reference information:LUO Feng,YOU Yu,WANG Jihong,LIU Hui,FANG Fang,WANG Xuying.Relationship between postoperative cerebrospinal fluid glutamate and secondary seizures in patients with glioma[J].Chinese Journal of Practical Nervous Diseases,2018,21(20):2299-2303.DOI:10.12083/SYSJ.2018.20.495