目的 研究奥拉西坦对癫痫模型大鼠的治疗效果及对大鼠Caspase-3、同型半胖氨酸(Hcy)水平的影响。方法 选取40只健康SD大鼠,分为正常组、模型组、低剂量组和高剂量组,对其中30只建立癫痫模型,正常组和模型组大鼠腹腔注射生理盐水;奥拉西坦组大鼠腹腔注射不同浓度的奥拉西坦。使用Morris水迷宫对4组大鼠学习记忆能力进行测试,并对大鼠海马区结构形态进行观察,观察记录大鼠癫痫持续时间、发作频率以及惊厥潜伏期时长,采用高效液相色谱法,检测大鼠海马组织Caspase-3、Hcy水平。结果 癫痫发作期间表现为阵发性肢体震颤、呼吸深且快,出现湿狗状抖动,站立不稳,并伴随阵发性抽搐、口吐白沫,兴奋性极高。模型组大鼠逃避潜伏期时长明显长于其他3组,奥拉西坦高剂量组大鼠逃避潜伏期时长短于奥拉西坦低剂量组(P<0.05);模型组大鼠穿越平台次数明显少于其他3组,奥拉西坦高剂量组大鼠穿越平台次数多于奥拉西坦低剂量组(P<0.05);模型组大鼠惊厥潜伏期明显短于其他2组,奥拉西坦高剂量组大鼠惊厥潜伏期明显长于奥拉西坦低剂量组(P<0.05);模型组模型大鼠癫痫持续时间及发作频率均显著高于其他2组,奥拉西坦高剂量组大鼠癫痫持续时间及发作频率均低于奥拉西坦低剂量组(P<0.05);正常组大鼠海马组织Caspase-3、Hcy水平显著低于其他3组,模型组Caspase-3、Hcy水平显著高于奥拉西坦2组(P<0.05);奥拉西坦高剂量组Caspase-3、Hcy水平低于奥拉西坦低剂量组(P<0.05)。结论 奥拉西坦对癫痫模型大鼠的治疗效果显著,对大鼠Caspase-3、Hcy水平有改善作用,为奥拉西坦在临床医学上的应用提供理论依据。
奥拉西坦对癫痫模型大鼠的治疗效果及对大鼠Caspase-3 Hcy水平的影响
于海燕1) 闵连秋2)△ 王东玉1 ) 包翠芳1)
1)锦州市中心医院神经内科,辽宁 锦州 121000 2)锦州医科大学附属第一医院神经内科,辽宁 锦州 121000
作者简介:于海燕,Email:sybcd25@163.com
△通信作者:闵连秋,Email:slqjv75@163.com
【摘要】 目的 研究奥拉西坦对癫痫模型大鼠的治疗效果及对大鼠Caspase-3、同型半胖氨酸(Hcy)水平的影响。方法 选取40只健康SD大鼠,分为正常组、模型组、低剂量组和高剂量组,对其中30只建立癫痫模型,正常组和模型组大鼠腹腔注射生理盐水;奥拉西坦组大鼠腹腔注射不同浓度的奥拉西坦。使用Morris水迷宫对4组大鼠学习记忆能力进行测试,并对大鼠海马区结构形态进行观察,观察记录大鼠癫痫持续时间、发作频率以及惊厥潜伏期时长,采用高效液相色谱法,检测大鼠海马组织Caspase-3、Hcy水平。结果 癫痫发作期间表现为阵发性肢体震颤、呼吸深且快,出现湿狗状抖动,站立不稳,并伴随阵发性抽搐、口吐白沫,兴奋性极高。模型组大鼠逃避潜伏期时长明显长于其他3组,奥拉西坦高剂量组大鼠逃避潜伏期时长短于奥拉西坦低剂量组(P<0.05);模型组大鼠穿越平台次数明显少于其他3组,奥拉西坦高剂量组大鼠穿越平台次数多于奥拉西坦低剂量组(P<0.05);模型组大鼠惊厥潜伏期明显短于其他2组,奥拉西坦高剂量组大鼠惊厥潜伏期明显长于奥拉西坦低剂量组(P<0.05);模型组模型大鼠癫痫持续时间及发作频率均显著高于其他2组,奥拉西坦高剂量组大鼠癫痫持续时间及发作频率均低于奥拉西坦低剂量组(P<0.05);正常组大鼠海马组织Caspase-3、Hcy水平显著低于其他3组,模型组Caspase-3、Hcy水平显著高于奥拉西坦2组(P<0.05);奥拉西坦高剂量组Caspase-3、Hcy水平低于奥拉西坦低剂量组(P<0.05)。结论 奥拉西坦对癫痫模型大鼠的治疗效果显著,对大鼠Caspase-3、Hcy水平有改善作用,为奥拉西坦在临床医学上的应用提供理论依据。
【关键词】 奥拉西坦;癫痫;同型半胖氨酸;海马区;SD大鼠
【中图分类号】 R-332 【文献标识码】 A 【文章编号】 1673-5110(2019)02-0117-07 DOI:10.12083/SYSJ.2019.02.024
Therapeutic effect of oxiracetam on epileptic model rats and its effect on the levels of Caspase-3 and Hcy in rats
YU Haiyan1),MIN Lianqiu2),WANG Dongyu1),BAO Cuifang1)
1)Department of Neurology,Jinzhou Central Hospital,Jinzhou 121000,China;2)Department of Neurology,the First Affiliated Hospital of Jinzhou Medical University,Jinzhou 121000,China
【Abstract】 Objective To investigate the therapeutic effect of Oxiracetam on epileptic model rats and the effects on the levels of Caspase-3 and homocysteine (Hcy).Methods 40 healthy SD rats were divided into normal group,model group,low-dose group and high-dose group,of which 30 were established epilepsy model.Normal group and model group rats were injected with normal saline intraperitoneally;rats in oxiracetam group were injected with different concentrations of oxiracetam intraperitoneally.Morris water maze was used to test the learning and memory abilities of four groups of rats.The hippocampal structure and morphology of rats were observed.The duration of epilepsy,seizure frequency and latency of convulsion were recorded.The levels of Caspase-3 and Hcy in hippocampus were detected by high performance liquid chromatography.Results During epileptic seizures,paroxysmal limb tremor,deep and rapid breathing,wet dog-like shaking,standing instability,and accompanied by paroxysmal convulsions,mouth foam,high excitability.The escape latency of the model group was longer than that of the other three groups,the escape latency of the high dose group was shorter than that of the low dose group (P<0.05),the number of platform crossing in the model group was significantly less than that of the other three groups,and the number of platform crossing in the high dose group was more than that in the low dose group(P<0.05);the convulsion latency of the model group was significantly shorter than that of the other two groups;the convulsion latency of the high-dose group was significantly longer than that of the low-dose group (P<0.05);the duration of epilepsy and seizure frequency of the model group were significantly higher than those of the other two groups;the duration of epilepsy in the high-dose group was significantly longer than that of the low-dose group (P<0.05).Intermittent and seizure frequencies were lower than those of oxiracetam low-dose group (P<0.05);Caspase-3 and Hcy levels in hippocampus of normal group were significantly lower than those of other three groups;Caspase-3 and Hcy levels in model group were significantly higher than those of oxiracetam high-dose group and oxiracetam low-dose group (P<0.05);Caspase-3 and Hcy levels in oxiracetam high-dose group were lower than those of oxiracetam low-dose group(P<0.05).Conclusion The Results of the treatment of epileptic model rats were significant,and the level of Caspase-3 and Hcy in rats was improved,which provided a theoretical basis for the clinical application of the clinical medicine.
【Key words】 Oxiracetam;Epilepsy;Homocysteine;Hippocampal area;SD rats
癫痫是一种常见的神经系统疾病,会严重影响患者的生活质量,增加家庭负担。许多抗癫痫类药物都会对患者的认知功能产生不同程度的损伤,所以寻求一种既能有效抑制癫痫发作,又能保护神经功能的抗癫痫药物成为了当下治疗癫痫的重要课题[1-2]。奥拉西坦是一种用于脑损伤以及神经功能缺失的药物,相关研究表明[3-4],奥拉西坦能够有效抑制癫痫患者的癫痫发作症状,并且对损伤神经组织进行组织和重建。蛋白酶Caspase-3和同型半胱氨酸(Hcy)作为两种常用的神经功能检测指标,可能参与了癫痫疾病的发病过程,并起重要的调控作用[5-6]。本文使用奥拉西坦对癫痫大鼠模型进行干预治疗,旨在探究奥拉西坦对癫痫的作用效果以及对Caspase-3、Hcy两种指标的影响。
1 材料与方法
1.1 实验动物 选取40只SD大鼠,由锦州医科大学实验动物中心提供,雄性,年龄3~6(3.8±1.5)个月,体质量200~250(220±7.9)g。所有大鼠均养殖在干净笼子里,室温在(22.1±1.8)℃,相对湿度35%~40%,光照12 h/d,喂饮纯净水,饲养时间为1周。2组大鼠在年龄、体质量上差异均无统计学意义。所做实验均获得我院伦理会批准。
主要试剂:兔抗大鼠Caspase-3抗体(均由根生化科技有限公司提供);小鼠抗大鼠Hcy、Cx43抗体(北京中杉金桥生物技术有限公司);戊四氮、奥拉美唑、氯化锂(上海国药集团化学试剂有限公司);PCR缓冲液、MgCl2溶液(北京中杉金桥生物技术有限公司);鲁米诺发光底液、MgCl2溶液(武汉博士德生物工程有限公司);Cx43 mRNA引物(Invitrogen公司);TUNEL细胞凋亡检测试剂盒(Sigma公司)。
1.2 方法
1.2.1 建模:将40只大鼠随机分为4组,各10只。对其中3组大鼠腹腔注射127 mg/kg的氯化锂,24 h后腹腔注射戊四氮(35 mg/kg)。给予另一组大鼠腹腔注射同体积的无菌生理盐水。PNASANI等[7]在注射戊四氮30 min后,观察大鼠出现的面肌抽动、咀嚼点头、前肢阵挛、站立、后肢阵挛以及跌倒等症状。根据Racine分级评价的标准分为[8]:Ⅰ级面部出现阵挛;Ⅱ级析出现节律性点头;Ⅲ级出现单侧前肢抽搐;Ⅳ级出现双前肢抽搐;Ⅴ级出现四肢抽搐以及失去平衡、跳跃并跌倒等。癫痫持续状态定义是Ⅳ级以上痫性发作并且能够持续30 min。如大鼠在建模过程中持续出现Ⅳ~Ⅴ级表现,说明建模成功,最终建模成功24只。
1.2.2 分组处理:将24只癫痫模型大鼠分为模型组、奥拉西坦低剂量组和奥拉西坦高剂量组各8只,另10只大鼠为正常组。低剂量组大鼠给予奥拉西坦射液的剂量为30 mL/(kg·d),高剂量组大鼠给予奥拉西坦射液的剂量为50 mL/(kg·d);正常组和模型组大鼠,给予腹腔注射等体积的生理盐水。连续给药处理7 d。给药处理过程中,注意观察大鼠的体温变化,各大鼠在给药处理期间均可以自由饮食。
1.2.3 学习记忆能力测试:GRABENSTATTER等[9]使用Morris水迷宫对4组大鼠学习记忆能力进行测试,建造直径1.25 m,高0.5 m的圆形水池,水深为0.3 m,水温保持在(26.5±0.8)℃。在池壁上设置四个不同的标志点,在水池中央设置一直径9 cm,高28 cm的深色平台,平台顶部位于水面下1.5 cm处。训练测试期间水迷宫外参照物不变。训练过程持续5 d,以四个标志点作为入水点,将大鼠放入池中,记录所有大鼠游至平台所用时长,若2 min内未找到平台,将其引至平台,潜伏期记为120 s。所有大鼠上台后均停留30 s,随后将其从不同的标志点放入水中再次检测。连续测试4 d,第5天撤去水中平台,将大鼠从池壁放入水中,记录1 min内大鼠穿越原平台位置次数。
1.2.4 癫痫发作情况:对3组癫痫模型大鼠进行观察,记录3组大鼠惊厥潜伏期、癫痫发作频率以及每次发作持续时间,并进行组间比较。
1.2.5 大鼠海马区形态学观察检测:所有大鼠样本在实验及各项目检测完成后均断头取脑,冠状切取视交叉4 mm脑组织,使用浓度为4%的多聚甲醛固定2 d,用石蜡包埋,然后常规脑组织切片,切片厚度约为5 μm,通过硫堇染色对大鼠的海马区形态进行观察,并用高倍的光学显微镜对海马CA1、CA3区每1 mm段内的胞核饱满、细胞膜完整、核仁清晰的锥体细胞情况进行观察统计。
1.2.6 标本采集及大鼠海马组织Caspase-3、Hcy水平检测:用手术刀割取所研究大鼠海马区组织,大小为1 cm×1 cm,保存在-50 ℃的冰箱中。使用前1 d取出,在5 ℃的环境中冰浴3 min后,用离心机以2 500 r/min的转速分离,取上清液,保存至-50 ℃的冰箱中。采用高效液相色谱法,将待测的标本注入在色谱柱中,在压力下进行固定相移动,经过固定相与待测标本中不同物质相互作用,物质会依次的离开色谱柱,应用检测器捕捉物质信号,严格按照高效液相色谱仪说明书上的操作步骤进行,对比分析所测的Caspase-3、Hcy水平。
1.3 统计学处理 采用SPSS 21.0统计软件进行分析处理。计量资料采用均数±标准差(x±s)表示,多组间比较采用F检验,P<0.05为差异有统计学意义。
2 结果
2.1 癫痫模型建立情况 使用30只大鼠进行建模,建模成功24只,癫痫发作期间表现为阵发性肢体震颤、呼吸深且快,出现湿狗状抖动,站立不稳,并伴随阵发性抽搐、口吐白沫,兴奋性极高。
2.2 大鼠行为学观察
2.2.1 4组大鼠空间学习记忆能力比较:如表1所示,模型组大鼠逃避潜伏期时长明显长于正常组、奥拉西坦低剂量组及奥拉西坦高剂量组,且奥拉西坦高剂量组大鼠逃避潜伏期时长短于奥拉西坦低剂量组,差异有统计学意义(P<0.05);模型组大鼠穿越平台次数明显少于正常组、奥拉西坦低剂量组及奥拉西坦高剂量组,且奥拉西坦高剂量组大鼠穿越平台次数多于奥拉西坦低剂量组,差异有统计学意义(P<0.05)。
2.2.2 3组癫痫大鼠惊厥潜伏期及痫样发作情况比较:如表2所示,模型组大鼠惊厥潜伏期明显短于奥拉西坦低剂量组及奥拉西坦高剂量组,且奥拉西坦高剂量组大鼠惊厥潜伏期明显长于奥拉西坦低剂量组,差异有统计学意义(P<0.05);模型组模型大鼠癫痫持续时间及发作频率均显著高于奥拉西坦低剂量组及奥拉西坦高剂量组,且奥拉西坦高剂量组大鼠癫痫持续时间及发作频率均低于奥拉西坦低剂量组,差异有统计学意义(P<0.05)。
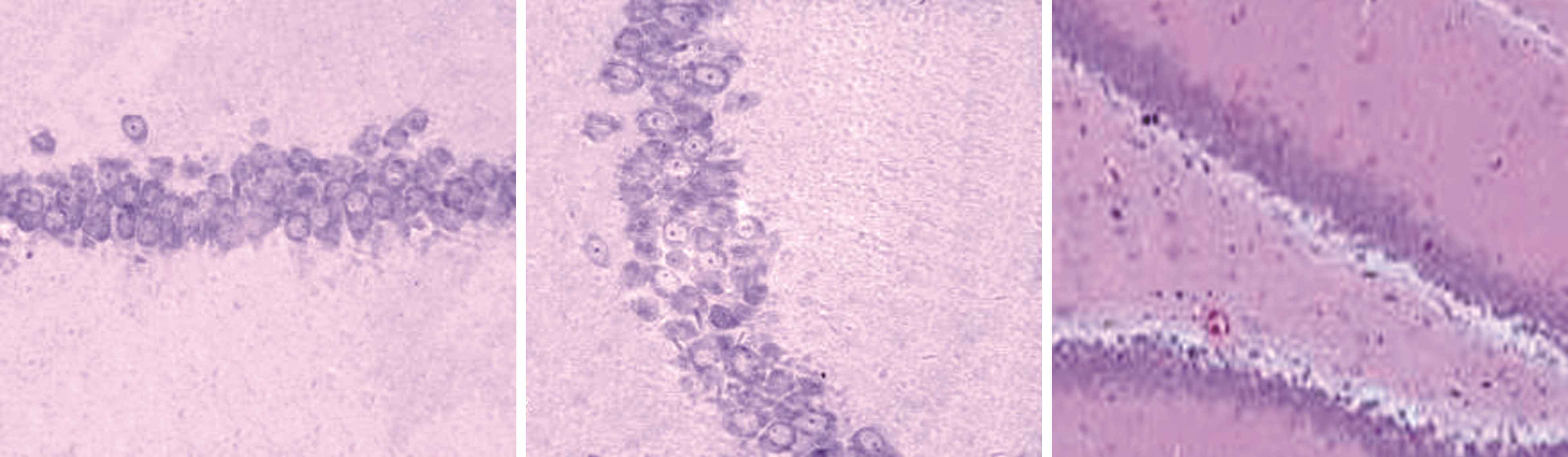
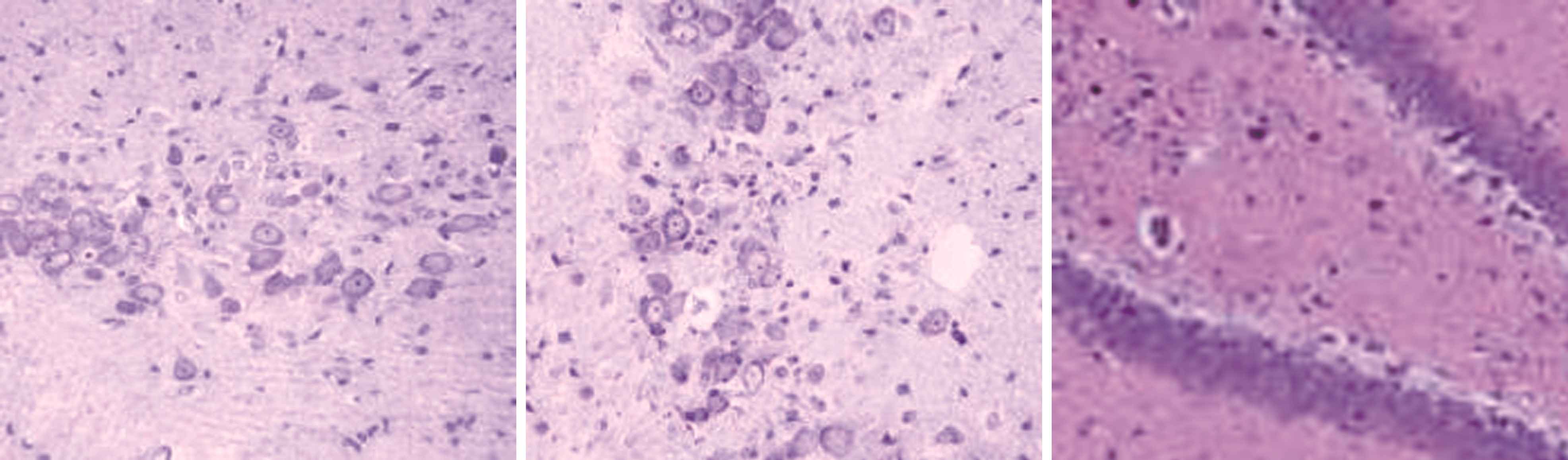
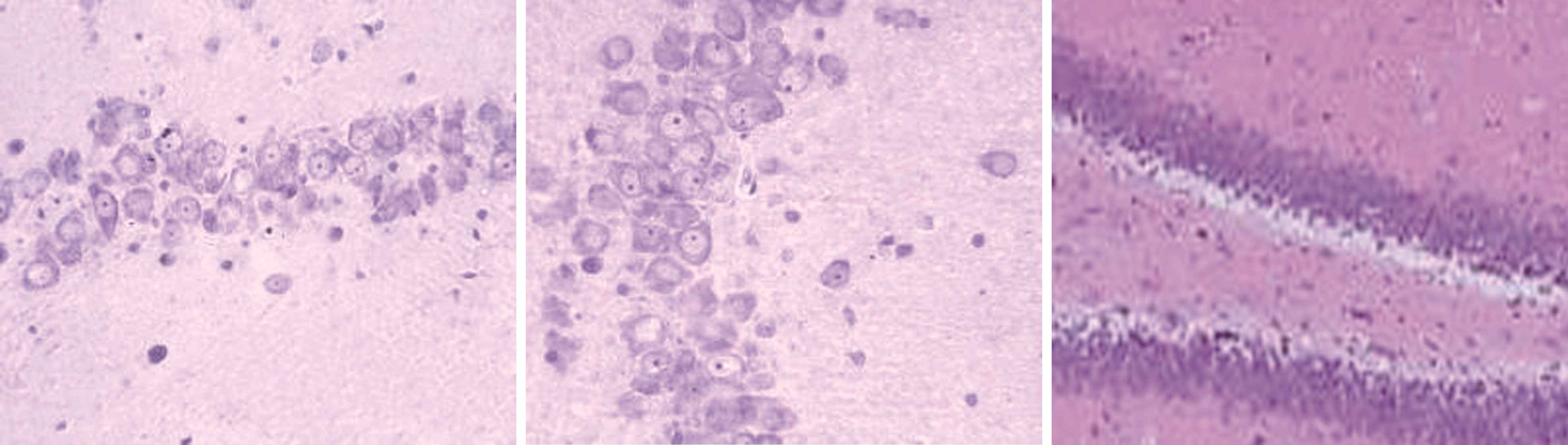
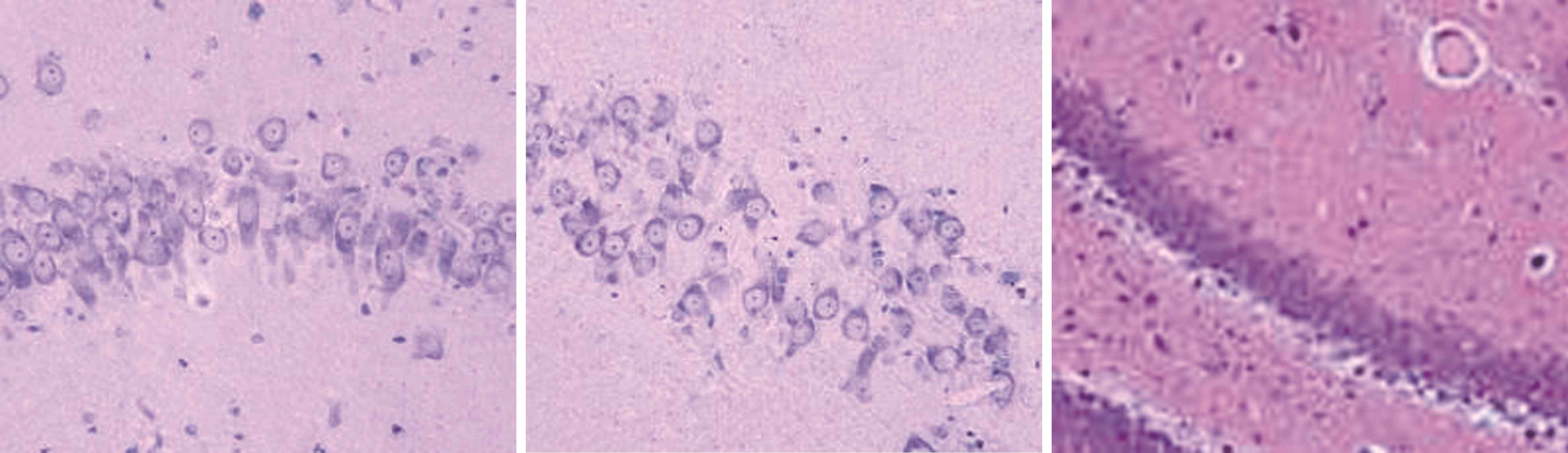
2.3 大鼠海马结构形态学观察 如图1所示,正常组和奥拉西坦高剂量组大鼠对侧海马无明显损伤,海马CA1、CA3区及齿状回细胞无缺失现象,形态完整,排列整齐,胞核饱满,核仁清晰,细胞有凸起且齿状回神经元呈带状分布,无苔状纤维发芽情况;模型组大鼠海马区域均可见较明显的组织损伤,海马CA1、CA3区及齿状回排列紊乱、细胞疏松、细胞形态由正常的多角形变为三角形或者不规则图形,残留锥体细胞周围能够见到较多的细胞碎片,且伴有胶质细胞浸润,苔状纤维发芽明显;低剂量奥拉西坦组大鼠海马区损伤明显少于模型组,排列较为紧密有序,且齿状回无明显神经元缺失状况,有轻微苔状纤维发芽情况。
表1 4组大鼠空间学习记忆能力比较 (x±s)
Table 1 Comparison of spatial learning and memory ability of 4 groups of rats (x±s)
| 组别 |
逃避潜伏期(s) |
穿越平台次数 |
| 第1天 |
第2天 |
第3天 |
第4天 |
| 正常组 |
40.13±3.45 |
31.56±4.21 |
27.25±3.21 |
22.06±2.77 |
1.94±0.42 |
| 模型组 |
51.12±3.33△ |
43.32±4.32△ |
36.29±3.22△ |
31.54±2.21△ |
0.76±0.33△ |
| 奥拉西坦低剂量组 |
48.31±3.21△* |
39.22±3.08△* |
32.15±3.96△* |
27.31±2.05△* |
1.41±0.31△* |
| 奥拉西坦高剂量组 |
44.21±3.22△*# |
34.58±2.56△*# |
29.27±3.31△*# |
24.56±2.37△*# |
1.75±0.28△*# |
| F值 |
10.28 |
8.73 |
8.89 |
11.81 |
9.74 |
| P值 |
<0.05 |
<0.05 |
<0.05 |
<0.05 |
<0.05 |
注:与正常组相比,△P<0.05;与模型组相比,*P<0.05;与奥拉西坦低剂量组相比,#P<0.05
表2 3组癫痫模型大鼠惊厥潜伏期及痫样发作情况比较 (x±s)
Table 2 Comparison of convulsion latency and epileptic seizures in 3 groups of epilepsy rats (x±s)
| 组别 |
n |
惊厥潜伏期(min) |
持续时间(h) |
发作频率(次/周) |
| 模型组 |
8 |
7.25±2.31 |
6.21±2.05 |
10.56±3.51 |
| 奥拉西坦低剂量组 |
8 |
10.36±3.11* |
4.03±1.56* |
6.31±2.55* |
| 奥拉西坦高剂量组 |
8 |
13.58±3.05*# |
2.16±0.98*# |
3.25±1.78*# |
| F值 |
|
7.02 |
7.56 |
7.88 |
| P值 |
|
<0.05 |
<0.05 |
<0.05 |
注:与模型组相比,*P<0.05;与奥拉西坦低剂量组相比,#P<0.05
表3 4组大鼠Caspase-3、Hcy水平比较 (x±s)
Table 3 Comparison of Caspase-3 and Hcy levels in 4 groups of rats (x±s)
| 组别 |
n |
Caspase-3(U/mg) |
Hcy(μmol/L) |
| 正常组 |
10 |
1.25±0.68 |
5.23±1.82 |
| 模型组 |
8 |
28.12±3.86△ |
17.53±4.84△ |
| 奥拉西坦低剂量组 |
8 |
16.06±1.82△* |
13.51±3.83△* |
| 奥拉西坦高剂量组 |
8 |
10.76±2.34△*# |
9.65±2.56△*# |
| F值 |
|
32.49 |
11.92 |
| P值 |
|
<0.05 |
<0.05 |
注:与正常组相比,△P<0.05;与模型组相比,*P<0.05;与奥拉西坦低剂量组相比,#P<0.05
正常组C1区 正常组C3区 正常组齿状回
模型组C1区 模型组C3区 模型组齿状回
低剂量组C1区 低剂量组C3区 低剂量组齿状回
高剂量组C1区 高剂量组C3区 高剂量组齿状回
图1 不同组别大鼠海马结构形态学观察(×200)
Figure 1 Morphological observation of hippocampal formation in different groups of rats(×200)
2.4 奥拉西坦对癫痫模型大鼠Caspase-3、Hcy水平的影响 如表3所示,3组癫痫模型大鼠Caspase-3、Hcy水平与正常组相比,差异有统计学意义(P<0.05)。正常组大鼠Caspase-3、Hcy水平显著低于模型组和奥拉西坦组,模型组Caspase-3、Hcy水平显著高于奥拉西坦2组,差异有统计学意义(P<0.05);奥拉西坦高剂量组Caspase-3、Hcy水平低于奥拉西坦低剂量组,差异有统计学意义(P<0.05)。
3 讨论
癫痫是一种慢性神经系统疾病,具有长期反复发作的特点,由于机体大脑神经元的异常突发性放电所导致的短暂性大脑功能障碍,同时也是人体发作性意识丧失的原因[10-11]。患有癫痫的患者在一定程度上会伴认知功能障碍,但造成这种认知功能障碍的原因目前还无准确性的研究结论[12-13]。
一直以来,人们对于癫痫发病机制的研究一直使用动物模型进行实验,戊四氮(PTZ)是一种中枢神经系统兴奋药物,依据戊四氮的药代动力学特点,可在短时间内使动物产生抽搐,而且这种抽搐的持续时间比较短,还可以自动停止,但能迅速使癫痫状态达到高峰[14-15]。用戊四氮作为一种致痫药物,使机体在导致癫痫后不会对自身的局部脑部组织造成破坏,而且还不会造成神经元的损伤和坏死,有利于对癫痫脑组织形态学的观察,所以采用戊四氮致痫的动物模型是非常理想的动物实验模型[16-17]。
本研究对癫痫大鼠采用奥拉西坦进行治疗取得较好抗癫痫效果。奥拉西坦是一种合成的羟基氨基丁酸环状衍生物,临床中主要适用于脑损伤以及脑损伤引起的记忆功能障碍和神经功能缺失等[18-19]。奥拉西坦能够穿过血脑屏障,能够分布在机体的海马区、纹状体、中隔区以及皮层区中,主要作用于门冬氨酸受体,可以通过胆碱能系统对蛋白激酶C产生激动作用,发挥改善脑组织能量代谢的作用,对神经功能缺损机体的定向力、大脑认知、记忆力以及抽象概括力作出有效改善[20-21]。奥拉西坦可以聚集未受损的脑组织进行重新组织和重建,从而恢复机体神经功能[22]。本研究通过Morris水迷宫对癫痫大鼠学习记忆能力进行测试,结果显示,在奥拉西坦作用下,癫痫大鼠学习记忆能力有显著增强,且随着奥拉西坦剂量的增加,增强效果更明显。本研究还对癫痫大鼠惊厥潜伏期、持续时间以及发作频率进行检测,结果显示,在奥拉西坦的作用下,癫痫大鼠惊厥潜伏期明显较短,发生频率以及持续时间更少,而且随着奥拉西坦剂量的增加,癫痫大鼠的发作潜伏期延长,发生频率以及持续时间明显减少,说明奥拉西坦对大鼠癫痫症状具有一定的抑制作用。
同型半胱氨酸(Hcy)属于一种兴奋性氨基酸[23],同型半胱氨酸由于过度的聚集会引起神经细胞兴奋性增加,对机体神经细胞造成损害,且同型半胱氨酸在癫痫疾病的发病中发挥非常重要的作用。同型半胱氨酸作为一种兴奋性物质[24],能够刺激N-甲基-D-天门冬氨酸受体,使神经元发挥毒性作用,造成机体神经功能的损害[25-26]。同型半胱氨酸不仅可以引起多系统的代谢毒作用,还以对癫痫症状起到加重的作用[27-28]。动物实验表明,同型半胱氨酸能够活化致癫灶[29],致使局灶性的癫痫发作,且同型半胱氨酸的高水平表达能够改变皮层脑电图,导致机体全身抽搐[30-31]。本研究中,癫痫大鼠模型在经过治疗后的同型半胱氨酸水平明显降低,而高剂量的用药治疗方式能够更加显著地对其水平产生抑制作用,说明在经过奥拉西坦治疗后,癫痫大鼠本身的同型半胱氨酸水平从高水平降低,减少了神经功能的损伤,改善了癫痫症状的产生,且用药的使用剂量可以稍微增加以提高治疗效果,与其他学者[32-33]的研究结果一致。Caspase-3是Caspase家族一种核心蛋白酶[34],能够介导细胞凋亡,也称死亡蛋白酶,在哺乳动物细胞凋亡中起到关键作用[35]。激活Caspase-3能够使细胞质、细胞核以及细胞骨架中的重要蛋白质降解失活,使蛋白酶级联反应被放大,从而引起细胞的凋亡[36]。相关研究表明,采用抗癫痫药物对癫痫对象进行干预后,Caspase-3的表达水平明显下降,说明Caspase-3在癫痫过程中起重要作用[37]。本研究中,经奥拉西坦治疗后的大鼠Caspase-3水平降低,说明奥拉西坦对Caspase-3的功能产生较为明显抑制作用,减少了神经细胞的凋亡,与丁绪平等[19]研究结论一致。
奥拉西坦能够对癫痫起到很好的抑制作用,延长癫痫的发作时间,减少发病次数,且能够降低Hcy和Caspase-3的表达水平,保护机体神经功能不受损伤。
4 参考文献
[1] XU T,YU X,WANG T,et al.The effect of CXCR2 inhibition on seizure activity in the pilocarpine epilepsy mouse model[J].Brain Res Bull,2017,134:91-98.
[2] DU X,CHEN Y,ZHAO Y,et al.Dramatic response to pyridoxine in a girl with absence epilepsy with ataxia caused by a de novo CACNA1A mutation[J].Seizure,2017,45:189-191.
[3] VAN WIERINGEN A,MEIJER J W,VAN EMDE BOAS W,et al.Pilot study to determine the interaction of oxiracetam with antiepileptic drugs[J].Clin Pharmacokinet,1990,18(4):332-338.
[4] ALDENKAMP A P,VAN WIERINGEN A,ALPHERTS W C,et al.Double-blind placebo-controlled,neuropsychological and neurophysiological investigations with oxiracetam (CGP 21690E) in memory-impaired patients with epilepsy[J].Neuropsychobiology,1990-1991,24(2):90-101.
[5] BAUD M O,KLEEN J K,MIRRO E A,et al.Multi-day rhythms modulate seizure risk in epilepsy[J].Nat Commun,2018,9(1):88.
[6] PETITO G T,WHAREN R E,FEYISSA A M,et al.The impact of stereotactic laser ablation at a typical epilepsy center[J].Epilepsy Behav,2018,78(11):37-44.
[7] PANSANI A P,CYSNEIROS R M,COLUGNATI D B,et al.Long-term monotherapy treatment with vitamin E reduces oxidative stress,but not seizure frequency in rats submitted to the pilocarpine model of epilepsy[J].Epilepsy Behav,2018,88:301-307.
[8] CONTRERAS-GARCA I J,PICHARDO-MACAS L A,SANTANA-GMEZ C E,et al.Differential expres-sion of synaptic vesicle protein 2A after status epilepticus and during epilepsy in a lithium-pilocarpine model[J].Epilepsy Behav,2018,88:283-294.
[9] GRABENSTATTER H L,FERRARO D J,WILLIAMS P A,et al.Use of Chronic Epilepsy Models in Antiepileptic Drug Discovery:The Effect of Topiramate on Spontaneous Motor Seizures in Rats with Kainate‐induced Epilepsy[J].Epilepsia,2010,46(1):8-14.
[10] ALONSO-VANEGAS M A,FREIRE CARLIER I D,SAN-JUAN D,et al.Parahippocampectomy as a New Surgical Approach to Mesial Temporal Lobe Epilepsy Caused By Hippocampal Sclerosis:A Pilot Randomized Comparative Clinical Trial[J].World Neurosurg,2018,110:e1063-e1071.
[11] LIU H Y,YANG Z,MENG F G,et al.Preoperative Heart Rate Variability as Predictors of Vagus Nerve Stimulation Outcome in Patients with Drug-resistant Epilepsy[J].Sci Rep,2018,8(1):3 856.
[12] HIRFANOGLU T,SERDAROGLU A,CETIN I,et al.Effects of vagus nerve stimulation on heart rate variability in children with epilepsy[J].Epilepsy Behav,2018,81:33-40.
[14] YU Y,HASEGAWA D,HAMAMOTO Y,et al.Neuropathologic features of the hippocampus and amygdala in cats with familial spontaneous epilepsy[J].Am J Vet Res,2018,79(3):324-332.
[15] MISHRA V,GAUTIER N M,GLASSCOCK E.Simultaneous Video-EEG-ECG Monitoring to Identify Neurocardiac Dysfunction in Mouse Models of Epilepsy[J].J Vis Exp,2018,2018(131).DOI:10.3791/57300.
[16] NAKAMURA Y,TOGAWA Y,OKUNO Y,et al.Biallelic mutations in,SZT2,cause a discernible clinical entity with epilepsy,developmental delay,macrocephaly and a dysmorphic corpus callosum[J].Brain Dev,2018,40(2):134-139.
[17] NEJM M B,HAIDAR A A,HIRATA A E,et al.Fish Oil Supplementation Reduces Heart Levels of Interleukin-6 in Rats with Chronic Inflammation due to Epilepsy[J].Front Neurol,2017,8:263.
[18] LIU X,LIAO Y,WANG X,et al.MicroRNA expression profiles in chronic epilepsy rats and neuroprotection from seizures by targeting miR-344a[J].Neuropsychiatr Dis Treat,2017,13:2 037-2 044.
[19] LAI Y C,LI N,LAWRENCE W,et al.Myocardial remodeling and susceptibility to ventricular tachycardia in a model of chronic epilepsy[J].Epilepsia Open,2018,3(2):213-223.
[20] YAO X L,YAO Z H,LI L,et al.Oxiracetam can improve cognitive impairment after chronic cerebral hypoperfusion in rats[J].Psychiatry Res,2016,246:284-292.
[21] HUANG L,SHANG E,FAN W,et al.S-oxiracetam protect against ischemic stroke via alleviating blood brain barrier dysfunction in rats[J].Eur J Pharm Sci,2017,109:40-47.
[22] WANG W,JI H,LI T,et al.Pharmacokinetic comparisons of S-oxiracetam and R-oxiracetam in beagle dogs[J].Acta Pharm,2016,66(2):279-287.
[23] GAO J,SHI J H,WANG J,et al.Effect of lamotrigine on the expression of Caspase-3 and heat shock protein 70 in hippocampus of epilepsy rats induced by pentetrazole[J].J Xinxiang Med Univ,2018,35(4):272-276.
[24] COPPOLA G,INGROSSO D,OPERTO F F,et al.Role of folic acid depletion on homocysteine serum level in children and adolescents with epilepsy and different MTHFR C677T genotypes[J].Seizure,2012,21(5):340-343.
[25] BELCASTRO V,STRIANO P.Antiepileptic drugs,hyperhomocysteinemia and B-vitamins supplementation in patients with epilepsy[J].Epilepsy Res,2012,102(1/2):1-7.
[26] NI G,QIN J,FANG Z,et al.Increased homocysteine levels in valproate-treated patients with epilepsy:a meta-analysis[J].Bmj Open,2014,4(7):e004936.
[27] HRNCIC D,RASICMARKOVIC A,BJEKICMACUT J,et al.Paradoxical sleep deprivation potentiates epilepsy induced by homocysteine thiolactone in adult rats[J].Exp Biol Med,2013,238(1):77-83.
[28] KOMULAINEN-EBRAHIM J,SAASTAMOINEN E,RAHIKKALA E,et al.Intractable Epilepsy due to MTR Deficiency:Importance of Homocysteine Analysis[J].Neuropediatrics,2017,48(6):467-472.
[29] KOMULAINEN-EBRAHIM J,SAASTAMOINEN E,RAHIKKALA E,et al.Intractable Epilepsy due to MTR Deficiency:Importance of Homocysteine Analysis[J].Neuropediatrics,2017,48(6):467-472.
[30] SHAKIR S,ALI N,UDIN Z,et al.Vitamin B6 and homocysteine levels in carbamazepine treated epilepsy of Khyber Pakhtunkhwa[J].African Health Sci,2017,17(2):559.
[31] PULIDO F L,PULIDO F M,QUESADA J P,et al.Comparative case-control study of homocysteine,vitamin B12,and folic acid levels in patients with epilepsy[J].Neurologia,2017,32(7):440.
[32] CHEN N C,CHEN C H,LIN T K,et al.Risk of Microangiopathy in Patients with Epilepsy under Long-term Antiepileptic Drug Therapy[J].Front Neurol,2018,9:113.
[34] DUTRA M R H,FELICIANO R D S,JACINTO K R,et al.Protective Role of UCP2 in Oxidative Stress and Apoptosis during the Silent Phase of an Experimental Model of Epilepsy Induced by Pilocarpine[J].Oxid Med Cell Longev,2018,2018:6736721.
[34] CUI Z Q,LI W L,LUO Y,et al.Methylene Blue Exerts Anticonvulsant and Neuroprotective Effects on Self-Sustaining Status Epilepticus (SSSE) Induced by Prolonged Basolateral Amygdala Stimulation in Wistar Rats[J].Med Sci Monit,2018,24:161-169.
[35] NAKAMURA Y,TOGAWA Y,OKUNO Y,et al.Biallelic mutations in,SZT2,cause a discernible clinical entity with epilepsy,developmental delay,macrocephaly and a dysmorphic corpus callosum[J].Brain Dev,2018,40(2):134-139.
[36] ZHOU Q,ZHU S,GUO Y,et al.Adenosine A1 Receptors Play an Important Protective Role Against Cognitive Impairment and Long-Term Potentiation Inhibition in a Pentylenetetrazol Mouse Model of Epilepsy[J].Mol Neurobiol,2018,55(4):3 316-3 327.
[37] YOSEFZON Y,SOTERIOU D,FELDMAN A,et al.Caspase-3 Regulates YAP-Dependent Cell Proliferation and Organ Size[J].Mol Cell,2018,70(4):573-587.
(收稿2018-09-07)
本文责编:关慧
本文引用信息:于海燕,闵连秋,王东玉,包翠芳.奥拉西坦对癫痫模型大鼠的治疗效果及对大鼠Caspase-3 Hcy水平的影响[J].中国实用神经疾病杂志,2019,22(2):117-123.DOI:10.12083/SYSJ.2019.02.024
Reference information:YU Haiyan,MIN Lianqiu,WANG Dongyu,BAO Cuifang.Therapeutic effect of oxiracetam on epileptic model rats and its effect on the levels of Caspase-3 and Hcy in rats[J].Chinese Journal of Practical Nervous Diseases,2019,22(2):117-123.DOI:10.12083/SYSJ.2019.02.024