目的 采用线栓法构建大鼠的中动脉缺血再灌注(middle cerebral artery occlusion,MCAO)模型,应用不同剂量辛伐他汀(HMG-COA reductase inhibitor)下调Caveolin-1表达,研究被不同程度抑制的Caceolin-1对BBB的作用。方法 160只雄性SD大鼠分成高、中、低剂量的辛伐他汀预处理组,同等剂量生理盐水缺血组及假手术组。预处理及生理盐水组连续灌胃给药7 d,最后一次灌胃3 h后建立MCAO,缺血2 h后抽出线栓再灌,假手术组仅结扎颈外动脉。手术24 h后进行神经功能评分,取脑分别进行TTC染色检测脑梗死体积、干湿质量法测量脑含水量、分光光度计测OD值测量伊文思蓝渗出、免疫组化法及蛋白印记杂交检测Caveolin-1的表达。结果 神经功能评分结果显示,全部辛伐他汀组明显优于生理盐水组(P<0.05);TTC染色示,低剂量及中剂量预处理组梗死体积百分比明显小于生理盐水缺血组(P<0.01),高剂量组未见优势,各预处理组两两比较,低及中剂量组梗死体积小于高剂量组(P<0.05);干湿质量百分率测定预处理组湿质量明显小于生理盐水缺血组(P<0.05),且各预处理组间两两比较发现中剂量组湿质量小于高剂量组(P<0.05);分光光度计测伊文思蓝渗透OD值结果,各给药组伊文思蓝渗透水平均低于生理盐水缺血组(P<0.05),各预处理组两两比较,低剂量组优于中及高剂量组且中剂量组优于高剂量组(P<0.05);Western Blot定量分析结果显示,各预处理组Caceolin-1表达水平均低于生理盐水缺血组(P<0.05),各给药组两两比较发现,随剂量增加Caveolin-1被降低水平增加即低剂量组<中剂量组<高剂量组(P<0.05);免疫组化示,Caveolin-1蛋白在各组大鼠脑组织中均沿微血管阳性表达,免疫组化染色半定量测量分布于血管内皮的Caveolin-1表达,除中与高剂量间差异无统计学意义(P>0.05)外,与Western Blot分析结果大概一致。结论 大鼠MCAO再灌注模型中Caveolin-1蛋白的表达量会增加。辛伐他汀的预处理可以有效抑制Caveolin-1的表达,适当剂量辛伐他汀可以通过抑制Caveolin-1表达保护血脑屏障完整,但过高或过低水平Caveolin-1蛋白都会破坏血脑屏障增大梗死的体积。
大鼠脑缺血再灌注损伤后HMG-COA还原酶抑制剂下调Caveolin-1表达对血脑屏障的影响
王 也 冯新红 毕国荣 武 剑
清华大学附属北京清华长庚医院 清华大学临床医学院,北京 102218
基金项目:北京清华长庚医院研究基金(编号:12015C1017)
作者简介:王也,Email:wangye8052@163.com
△通信作者:武剑,Email:wujianxuanwu@126.com
【摘要】 目的 采用线栓法构建大鼠的中动脉缺血再灌注(middle cerebral artery occlusion,MCAO)模型,应用不同剂量辛伐他汀(HMG-COA reductase inhibitor)下调Caveolin-1表达,研究被不同程度抑制的Caceolin-1对BBB的作用。方法 160只雄性SD大鼠分成高、中、低剂量的辛伐他汀预处理组,同等剂量生理盐水缺血组及假手术组。预处理及生理盐水组连续灌胃给药7 d,最后一次灌胃3 h后建立MCAO,缺血2 h后抽出线栓再灌,假手术组仅结扎颈外动脉。手术24 h后进行神经功能评分,取脑分别进行TTC染色检测脑梗死体积、干湿质量法测量脑含水量、分光光度计测OD值测量伊文思蓝渗出、免疫组化法及蛋白印记杂交检测Caveolin-1的表达。结果 神经功能评分结果显示,全部辛伐他汀组明显优于生理盐水组(P<0.05);TTC染色示,低剂量及中剂量预处理组梗死体积百分比明显小于生理盐水缺血组(P<0.01),高剂量组未见优势,各预处理组两两比较,低及中剂量组梗死体积小于高剂量组(P<0.05);干湿质量百分率测定预处理组湿质量明显小于生理盐水缺血组(P<0.05),且各预处理组间两两比较发现中剂量组湿质量小于高剂量组(P<0.05);分光光度计测伊文思蓝渗透OD值结果,各给药组伊文思蓝渗透水平均低于生理盐水缺血组(P<0.05),各预处理组两两比较,低剂量组优于中及高剂量组且中剂量组优于高剂量组(P<0.05);Western Blot定量分析结果显示,各预处理组Caceolin-1表达水平均低于生理盐水缺血组(P<0.05),各给药组两两比较发现,随剂量增加Caveolin-1被降低水平增加即低剂量组<中剂量组<高剂量组(P<0.05);免疫组化示,Caveolin-1蛋白在各组大鼠脑组织中均沿微血管阳性表达,免疫组化染色半定量测量分布于血管内皮的Caveolin-1表达,除中与高剂量间差异无统计学意义(P>0.05)外,与Western Blot分析结果大概一致。结论 大鼠MCAO再灌注模型中Caveolin-1蛋白的表达量会增加。辛伐他汀的预处理可以有效抑制Caveolin-1的表达,适当剂量辛伐他汀可以通过抑制Caveolin-1表达保护血脑屏障完整,但过高或过低水平Caveolin-1蛋白都会破坏血脑屏障增大梗死的体积。
【关键词】 缺血再灌注损伤;Caveolin-1;血脑屏障;HMG-COA还原酶抑制剂
【中图分类号】 R-332 【文献标识码】 A 【文章编号】 1673-5110(2019)04-0349-09 DOI:10.12083/SYSJ.2019.04.118
HMG-COA reductase inhibitor induced blood-brain barrier permeability decrease is mediated by downregulation of caveolin-1 protein after middle cerebral artery occlusion and reperfusion injury rats
WANG Ye,FENG Xinhong,BI Guorong,WU Jian
Beijing Tsinghua Changgung Hospital,School of Clinical Medicine,Tsinghua University,Beijing 102218,China
【Abstract】 Objective To investigate the relationship between the effects of HMG-COA reductase inhibitor downregulates the expression of caveolin-1 and degree of permeability of BBB increased in the rats that accept surgery for middle cerebral artery occlusion.Methods Adult male SD rats (270-320 g) were purchased from the center for experimental animals,China Medieal University.Animals were randomly assigned to control,sham-operated group and simvastatin groups.Different degree of simvastatin (100 mg/(kg·d),60 mg/(kg·d) and 30 mg/(kg·d)) were given orally to the rats onece a day for 7 days before operation.Saline was given in the same way in the eontrol group.All groups above were performed surgery for middle cerebral artery occlusion (MCAO) with sham-operated group excepted.The following Procedures should be taken:Observation of behavioral testing;Evaluation of infarct volume by TTC testing;Weigh the dry/wet weight ratio;Measurement the permeability of BBB by tseting extravasation of Evans blue dye using spectrophotometer,Immunohistochemical assessment,Westen blot assessment.Results All groups accept treatment of simvastatin revealed that the score of behavioral testing were superior to control group (P<0.05).All groups accept treatment of simvastatin showed less infarct volume than control group by TTC testing (P<0.05).In addition,both low and middle dose group reveal less infarct volume than high dose group (P<0.05).The Resultsof ratio of the dry/wet weight revealed that all groups accept treatment of simvastatin show less ratio than control group (P<0.05).Meanwhile,the middle dose group reveal less ratio than high dose group (P<0.05).Measuring the extravasation of Evans blue dye by spectrophotometer revealed that all groups accept treatment of simvastatin show less OD than control group (P<0.05).Western blot analysis on expression of cav-1 showed that ischemia-reperfusion induced the up-regulation of cav-1 (P<0.05) by calculating the gray level ratio.Thus,the level of Caveolin-1 expression decreased with the increase of dose (high<middle<low dose group) (P<0.05).Effects on the expression of caveolin-1 by immunohistochemisitry showed that the expression of caveolin-1 protein was investigated in the microvessel fragnlents of ischemic brain tissue.Caveolin-1 expression was in common with the result of western blot analysis except that there hasn’t statistically significant between middle dose and high dose group (P>0.05).Conclusion The advent of cerebral I/R injury may evoke the overexpression of Caveolin-1 in rats.Pretreatment of statins exert direct down-regulation effects on Caveolin-1.A suitable dose of statins may induce BBB permeability decrease by downregulation of Caveolin-1 protein,so important as that extreme high or low dose induced larger infarction volumes.
【Key words】 Cerebral ischemia and reperfusion injury;Caveolin-1;Blood-brain barrier;HMG-COA reducase inhibitor
急性脑梗死是一个复杂的病理生理过程,包括缺血期原发性损伤和再灌注期的继发性损伤,其机制与自由基损伤机制、细胞内钙离子超载机制、兴奋性氨基酸机制、一氧化氮和炎症反应机制等。中枢神经系统错综复杂,随着近年来医学界对其多种细胞的形态及功能的进一步认识,对脑梗死后神经损伤机制和作用靶点的研究取得一定进展,但仍然存在许多盲点。长期以来缺血性卒中的防治研究大多局限于神经元本身,忽略了神经系统的整体性和不同结构间的相互作用[1]。2002年,美国神经疾病与卒中研究所首次提出了神经血管单元(neurovascular unit,NVU)的概念,此概念强调组成NVU的神经元、胶质细胞和血管成份必须作为一个多类型细胞构成的复杂结构和功能体系[2]。中枢神经系统的血管结构中有一个重要特点是形成血脑屏障(blood-brain barrier,BBB),其构成包括脑微血管内皮细胞(brain microvascular endothelial cells,BMECs)、基底膜和星形胶质细胞的血管周足,其成员的交集使得NVU的内涵还包括BBB。
BBB是一种保护性生物膜屏障,主要将中枢神经系统与外界分隔。决定其通透性的主要因素是细胞旁路与跨细胞途径。细胞旁路途径主要由紧密连接(tight junction,TJ)介导;跨细胞途径主要由内源性的运载体介导,主要包括4类:载体介导的运载体(CMT)/主动运出的运载体(AET)/受体介导的运载体(RMT),以及Caveolae主导的细胞吞、胞饮和穿胞吞排作用[3]。
Caveolae——胞膜窖/细胞质膜微囊于19世纪50年代发现,是细胞膜表面的富含胆固醇、鞘磷脂和鞘糖脂的特异性疏水内陷结构,形状50~100 nm的“Ω”样或者烧瓶结构。目前已知Caveolae在哺乳动物中广泛存在于各种类型细胞中,尤其在内皮细胞、上皮细胞、成纤维细胞等最为丰富。其参与受体介导转运小分子(胞饮作用),以及参与多种细胞调节作用,比如信号转导、细胞生长、细胞凋亡以及脂类代谢等。Caveolins是Caveolae的主要结构蛋白及标记蛋白,包含3个成员:Caveolin-1、Caveolin-2及Caveolin-3。Caveolin-1及Caveolin-2多存在于脂肪、内皮细胞、上皮细胞、成纤维细胞、肺组织等中,Caveolin-3主要存在于心肌、骨骼肌、横纹肌中,本研究致力于中枢神经系统存在的Caveolin-1蛋白。
国际上对于脑缺血再灌注后中枢神经系统Caveolin-1的研究已经开展了多年,有报道称敲除Caveolin-1基因的大鼠BMECs通透性升高[4]且缺血再灌注后出现的梗死体积更大[5-6],根据目前报道文献其机制可能通过:(1)Caveolin-1调控NOS演化阶段调控NO表达影响NO的信号通路:一方面,NO可以从mRNA及蛋白角度下调Caveolin表达;另一方面,Caveolin-1可使NOS所有的3个亚型失活来下调NO水平[7]。有文献报道,Caveolin-1对NO调节构成了正反馈作用,能够使NO在脑缺血后都持续上升。NO是把“双刃剑”同时具备损伤保护的双重作用,在I/R早期内皮型一氧化氮合酶(eNOS)表达合成适量的NO保护脑组织,还能降低血小板的聚集力、抑制白细胞的黏附、扩张血管和增加脑血流等作用;亚急性期时除了eNOS外还有神经型一氧化氮合酶(nNOS)和诱导型一氧化氮合酶(iNOS)表达,会产生高浓度的NO与氧自由基反应生成氧合超氧化氮阴离子(ONOO-)和羟自由基(RNS)破坏BBB[8-9]。(2)Caveolin-1藉由NO下调基质金属合酶(MMPs)表达,目前国内外针对MMPs表达的报道较多,在脑缺血再灌注损伤急性期各类型的MMPs前体均被NO介导的“半胱氨酸开关”前体区域的S-亚硝酸化作用将前体激活,或NO产生的过氧化亚硝酸盐自由基刺激下直接断裂“半胱氨酸开关”,激活MMPs[10],上调各类型的MMPs表达。尤其MMPs-2和-9的过表达会降解脑基质、破坏紧密连接蛋白、加重脑水肿和出血转化风险,并导致血管神经单元中的BBB出现双期开放——第一时相开放与MMP-2活化有关[11-12],而第二时相开放与MMP-9活化有关[13]。
目前存在一个有趣的现象是相当数量的文献报道I/R后Caveolin-1蛋白的表达水平存在明显矛盾,GU等[8]及SHEN等[7]阐述脑缺血再灌注后Caveolin-1表达降低,然而NAG等[14]及JEAN-FRAN等[15]研究结论则是大鼠脑MCAO模型后Caveolin-1表达大幅度增加,且这两种观点中对Caveolin-1这一蛋白对BBB的角色描述也是截然相反的。对这一现象的解释尚不明确,可能是由于实验条件不同,因此还需要进一步的实验研究血脑屏障和Caveolin-1的关系。
他汀类药物(statins)即3-羟基3-甲基戊二酸单酰辅酶A(3-hydro2xy-3-methylglutaryl coenzyme A,HMG-CoA)还原酶抑制剂,是一类强效降胆固醇药物,具有安全性高、耐受性好等优点。大量实验和临床研究表明,他汀具有调控血脂、稳定动脉粥样硬化斑块、预防卒中的复发等作用。以往的报道中证实他汀能降低心血管内Caveolin-1的表达[16],且这一过程与调脂无关[17],目前颅内段血管研究尚少。由于辛伐他汀、洛伐他汀、氟伐他汀相对亲脂性强,可透过血脑屏障,本实验选择辛伐他汀作为预处理,拟定给以不同剂量辛伐他汀预处理与生理盐水组比较,进一步研究给以不同剂量HMG-COA还原酶抑制剂预处理后,被不同程度下调的Caveolin-1对血脑屏障通透性的作用。
1 材料与方法
1.1 实验动物准备及分组 SPF级雄性大鼠适应性喂养1周后,随机分成辛伐他汀低剂量组[3 mg/(kg·d)]、中等剂量组[6 mg/(kg·d)]、高剂量组[10 mg/(kg·d)]、生理盐水缺血组、假手术组。给药组将辛伐他汀溶于生理盐水按0.67 mL/100 g灌胃使个组给液体量相当,生理盐水组及假手术组采用同等剂量生理盐水灌胃,1次/d,连续7 d,最后一次灌胃3 h后造模。
1.2 MCAO模型制备 将传统MCAO线栓法加以改进,以10%水合氯醛(0.3 mL/100 g)腹腔注射给药麻醉。分离右侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)、颈内动脉(internal carotid artery,ICA)。结扎ECA,电凝离断颈外动脉后显微剪口,将线栓由ECA剪口插入CCA分叉,线栓继续进入ICA,当遇到轻微阻力时停止,此时线栓插入深度为18~20 mm。2 h后再灌,将大鼠再次麻醉,剪开切口缝合线,将鱼线抽出5 mm,此时MCA血流再通。假手术组仅结扎ECA后缝合。
1.3 神经功能评分 参照Zea Longa 5分制评分标准,进行评定。0分:无神经损伤症状;1分:对侧前爪不能完全伸直;2分:行走时向对侧转圈;3分;站立不稳,向对侧倾倒;4分:不能自发行走;意识丧失。术后约1 h动物可苏醒,观察神经功能缺失情况。累计2分或2分以上即为成功模型。
1.4 干湿质量法测脑含水量 每组取7只大鼠,断头取脑组织,以视交叉前2 mm和乳头体为标志冠状切为前、中、后三段,每段分为健侧和患侧,万分之一电子分析天平秤取脑湿质量,置于100 ℃烤箱中烘烤至恒重(即2次测量质量相同)时秤取脑干质量,按公式:脑组织含水量=(湿质量-干质量)/湿质量×100%,测算出脑组织的含水量百分比。
1.5 伊文思蓝渗透法 梯度配制标准品:EB 4.73 mg加入生理盐水至25 mL,取0.3 mL加入5.7 mL二甲基甲酰胺混匀为第一管,从第一管中取出3 mL加入3 mL二甲基甲酰胺为第二管,第二管对比稀释为第三管,依次类推共7管,浓度依次为9.46、4.73、2.37、1.18、0.591、0.296、0.148 μg/mL。置于分光光度计(波长620 nm)测光密度OD值(以蒸馏水作空白比色)。以浓度为横坐标,以吸光度为纵坐标,带入数据求得回归方程:Y=A×X+B。每组取5只大鼠,用10%水合氯醛麻醉后,经股静脉注射EB(生理盐水配至2 mL/kg),2 h后断头取脑。取其中5只,左右大脑半球分开称质量,每克脑组织加入2 mL甲酰胺后,置于50 ℃恒温水浴箱,加盖遮光水浴72 h,然后3 000 r/min离心10 min,取上清液,置于分光光度计(波长620 nm)测光密度OD值(以蒸馏水作空白比色)。
1.6 TTC染色法测定梗死体积 每组取5只大鼠,用10%水合氯醛麻醉后,经左心室迅速灌注PBS 150 mL,快速断头取脑,将脑切成2 mm厚,放于4% TTC染液中,37 ℃温育15 min。TTC仅能被线粒体功能正常的细胞摄取,因此梗死区不着色,正常脑细胞染成橘红色,用图像处理软件(Photoshop)磁性套索像素比例计算梗死面积(橘红色区域为正常脑组织,白色区域为梗死区)、各脑片梗死面积之和乘以厚度(2 mm)为总的梗死容积。梗死体积百分率=(正常侧大脑半球体积-梗死侧非梗死区脑组织体积)/正常侧大脑半球体积×100%。
1.7 Western Blot分析 每组随机取5只大鼠,冰上操作腹主动脉放血处死后,迅速取脑存入液氮罐转存于-80 ℃冰箱中。按TTC试验中所示的梗死部位取梗死侧脑皮质100 mg,置于1.5 mL EP管内放入冰盒中,PBS清洗后加RIPA 800 μL,剪刀剪碎后超声,低温离心(4 ℃,1 400 r/min,30 min),取上清做BCA蛋白定量(1∶10及1∶100比例),测得吸光度、上样浓度及曲线。取上清100 μL加入上样缓冲液后蛋白变性(100 ℃,10 min)。制胶后每泳道上样8 μL,彩虹Marker 5 μL。浓缩胶80 V,分离胶120 V恒压电泳至溴酚蓝溢出为止,100 V恒压转膜1 h,脱脂奶粉封闭2 h,TBST清洗5 min×3次,一抗(兔大鼠抗体Caveolin-1,Santa Cruz)、GAPDH(1∶2 000)封闭16 h。取出膜后TBST清洗5 min×3次,二抗(山羊抗兔1∶2 000)结合2 h,TBST清洗5 min×3次,ECL发光。蛋白条带光密度分析,半定量结果=目标蛋白条带光密度/GAPDH蛋白条带光密度。
1.8 免疫组化分析 每组随即取8只大鼠,以10%水合氯醛麻醉后,大鼠沿胸骨左侧剪开胸腔,从左心室进针,插入到主动脉,固定针头,剪开右心耳,快速滴入预冷生理盐水200 mL,无血污后改滴入冷4%多聚甲醛200 mL后断头取脑,取缺血侧大脑半球中1/3,置4%多聚甲醛固定48 h,过缸后制成石蜡切片,切片浸入0.01 mol/L EDTA,高压锅加热至沸腾,盖加压阀高压7 min,室温冷却20 min;0.01 mol/L PBS洗2 min×3次;滴加抗Caveolin-1大鼠抗体(兔大鼠抗体Caveolin-1,Santa Cruz),4 ℃冰箱过夜,0.01 mol/L PBS洗2 min×3次;加入兔抗大鼠IgG抗体-HRP多聚体二抗,室温孵育30 min,0.01 mol/L PBS洗2 min×3次;滴加DAB显色剂至显微镜下出现着色清晰、境界明确的棕黄色阳性产物,1~2 min蒸馏水充分冲洗,苏木素复染1 min,自来水中止反应;1% HCl酒精分化20 s,自来水洗1 min;氨水返蓝30 s,自来水洗1 min;梯度酒精脱水、二甲苯透明、中性树胶封片。同时用PBS代替一抗作空白对照以检查免疫反应的特异性。
1.9 统计学处理 采用SPSS 20.0计学软件进行数据处理,数据以均数±标准差(x±s)表示。多组样本间均数比较采用方差分析,2组样本间均数比较采用两组独立t检验。P<0.05为差异有统计学意义。
2 结果
2.1 神经功能评分 各组大鼠在造模成功后,均进行神经功能评分并记录20只得分情况,观测得分示全部辛伐他汀预处理组明显优于生理盐水缺血组(P<0.01)。见表1。各组方差分析F=5.716,P=0.001,给予不同剂量他汀预处理对神经功能评分影响差异有统计学意义。
2.2 干湿质量法测脑含水百分比检测BBB通透性 依据公式计算干湿质量百分率,结果显示,全部预处理组湿质量明显小于生理盐水缺血组(P<0.05),且各预处理组间两两比较发现中剂量组湿质量小于高剂量组(t=5.092,P=0.024<0.05)。见表2;各组方差分析F=8.824,P=0.01,给予不同剂量他汀预处理对脑组织中水含量百分比差异有统计学意义。
表1 各组神经功能评分比较 (x±s,n=20)
Table 1 Comparison of neurological function score of each group (x±s,n=20)
| 组别 |
n |
神经功能评分 |
t值 |
P值 |
| 假手术组 |
20 |
0±0 |
|
|
| 缺血组 |
20 |
2.50±0.69 |
2.871** |
0.007 |
| 低剂量组 |
20 |
1.95±0.51 |
3.390** |
0.002 |
| 中剂量组 |
20 |
1.80±0.62 |
3.213** |
0.003 |
| 高剂量组 |
20 |
1.85±0.59 |
|
|
注:各预处理组与缺血组相比,** P<0.01
2.3 伊文思兰渗透法检测BBB通透性 使用梯度法配制标准品后,用分光广度计测取OD值,根据梯度浓度算得A=0.0275,B=0.0616,C=0.787,将数据带入方程Y=A×X+B,获取公式Y=0.0275×X+0.0616。测伊文思蓝渗透OD值结果,各给药组伊文思蓝渗透水平均低于生理盐水组(P<0.05),各预处理组两两比较低剂量组优于中及高剂量组(P<0.05),且中剂量组优于高剂量组(P<0.05)。见表3。各组方差分析F=140.916,P=0.000,给予不同剂量他汀预处理对脑组织中EB含量影响差异有统计学意义。
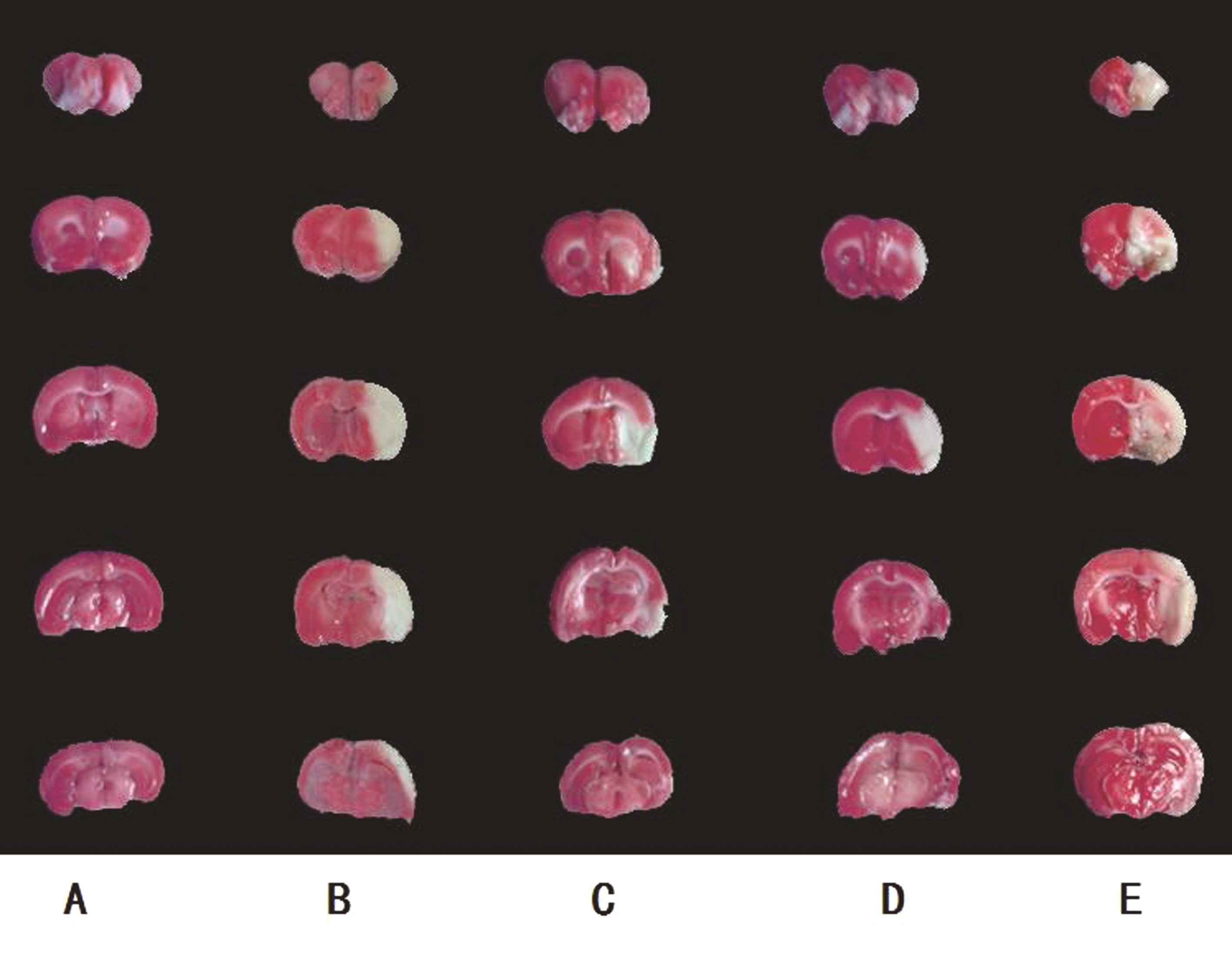
2.4 TTC染色 TTC染色结果显示,假手术组未见任何梗死,所有低剂量及中剂量的预处理给药组梗死体积百分比明显小于生理盐水组(P<0.01),高剂量组未见优势反出现梗死体积变大,各剂量预处理组间两两比较低及中剂量组梗死体积均小于高剂量组(P<0.05),见图1、表4。各组方差分析F=12.455,P=0.000,给予不同剂量他汀预处理对脑组织梗死体积百分比影响差异有统计学意义。
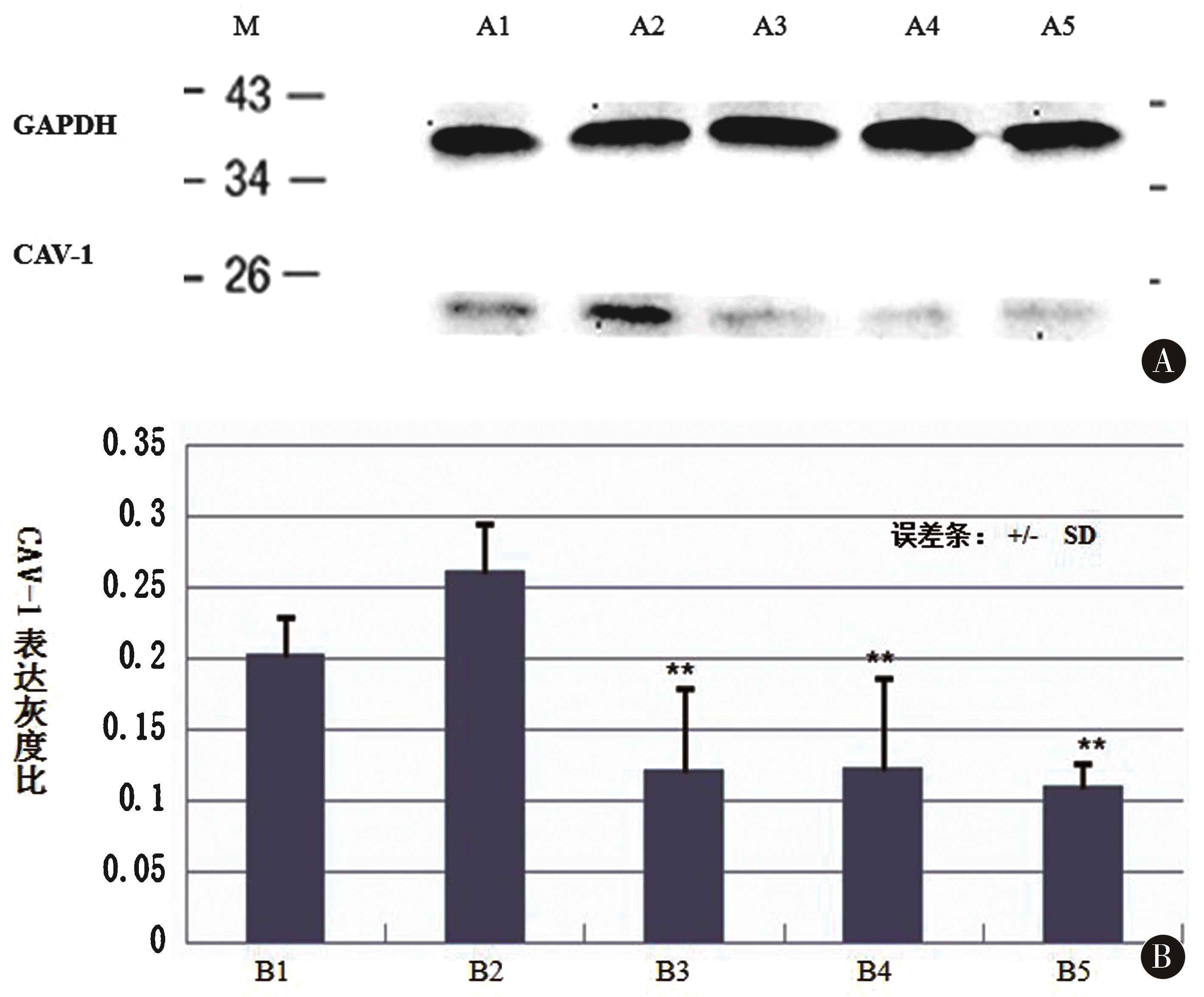
2.5 梗死半球皮质部位Caceolin-1表达情况 Western blot使用目的条带与对应内参GAPDH灰度的比值做定量分析,结果显示,各预处理组Caceolin-1表达水平均低于生理盐水缺血组(P<0.05),生理盐水缺血组Caceolin-1水平明显增高,且高于假手术组,各给药组两两比较发现随剂量增加Caveolin-1被降低水平增加,即低剂量<中剂量(P<0.05)和中剂量低于高剂量(P<0.05),各预处理组与假手术组分别对比结果Caveolin-1表达水平均降低(P<0.05)。见图2。
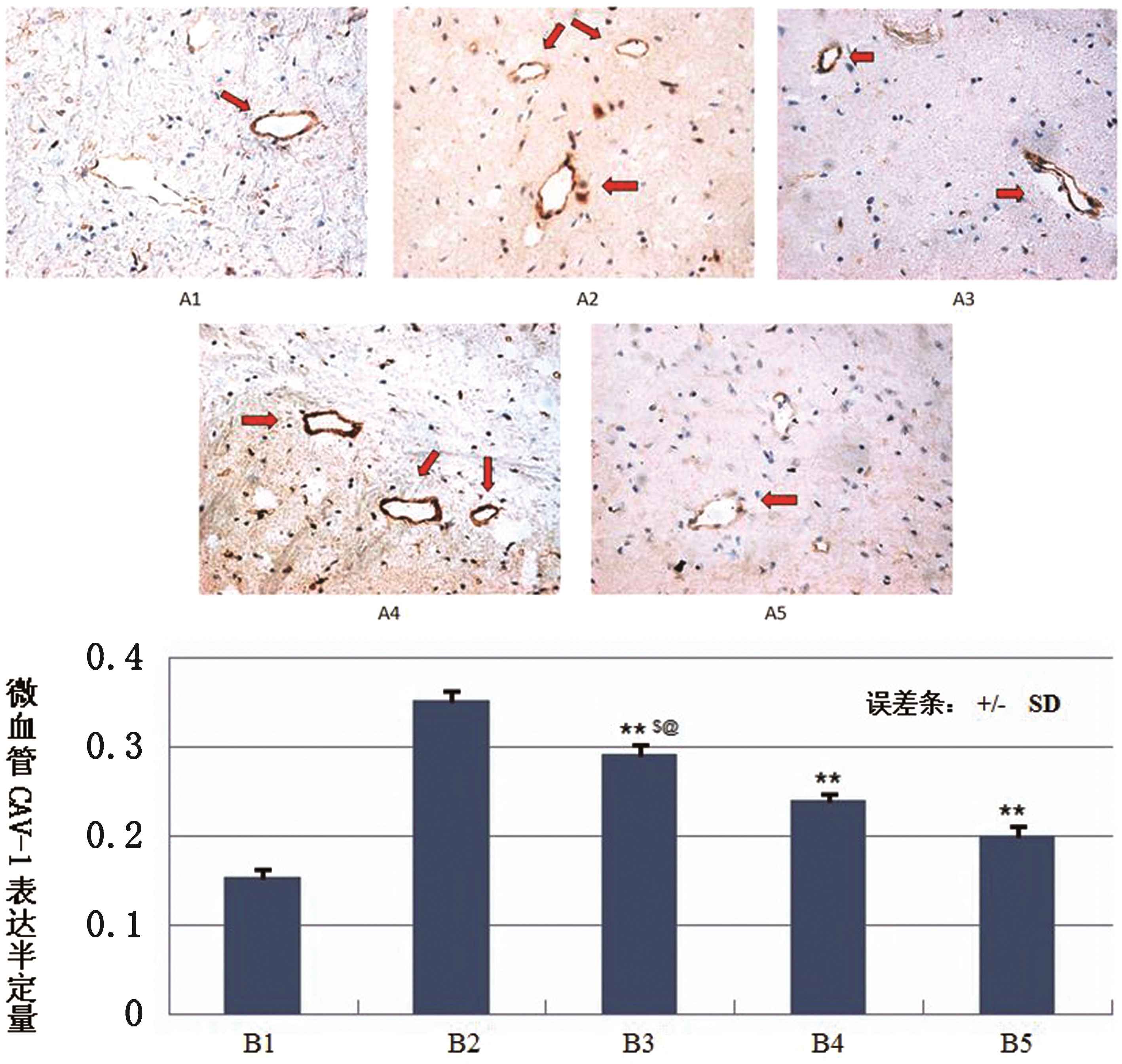
2.6 各组梗死半球皮质微血管段Caceolin-1表达情况 免疫组化示Caveolin-1蛋白在各组大鼠脑组织中均沿微血管阳性表达(图3),免疫组化染色半定量测量分布于血管内皮的Caveolin-1表达,与Western blot分析结果大概一致,全部预处理组表达水平均低于与生理盐水缺血组(P<0.05),各剂量给药组两两比较,高及中剂量组少于低剂量(P<0.05),中与高剂量之间差异无统计学意义(P>0.05)。
表2 各组脑含水量百分比比较 (x±s)
Table 2 Comparison of percentage of brain water content of each group (x±s)
| 组别 |
n |
脑含水量百分比/% |
t值 |
P值 |
| 假手术组 |
5 |
78.75±1.05 |
— |
— |
| 缺血组 |
5 |
83.71±0.34 |
— |
— |
| 低剂量组 |
5 |
77.27±4.15 |
3.462** |
0.025 |
| 中剂量组 |
5 |
78.59±0.85 |
15.147** |
0.000 |
| 高剂量组 |
5 |
81.11±0.55 |
7.967** |
0.001 |
注:各预处理组组与生理盐水缺血组相比,*P<0.05,**P<0.01;中剂量组与高剂量组相比,$P<0.05
表3 各组脑Evans蓝含量比较 (x±s)
Table 3 Comparison of brain Evans Blue content of each group (x±s)
| 组别 |
n |
脑组织EB含量(ug/g) |
t值 |
P值 |
| 假手术组 |
5 |
76.87±51.18 |
— |
— |
| 缺血组 |
5 |
614.67±26.29 |
— |
— |
| 低剂量组 |
5 |
295.11±7.41 |
4.631 |
0.000 |
| 中剂量组 |
5 |
192.00±47.00 |
17.55 |
0.000 |
| 高剂量组 |
5 |
373.65±40.52 |
6.861 |
0.000 |
| 各给药组间两两t检验 |
|
|
|
|
| 低与中剂量组 |
|
|
4.846 |
0.007 |
| 低与高剂量组 |
|
|
-4.263 |
0.011 |
| 中与高剂量组 |
|
|
-6.545 |
0.000 |
注:各预处理组与缺血组相比,**P<0.01
图1 按剂量组显示出白色梗死区域 A:假手术组未见任何梗死;B:盐水缺血组梗死体积最大;C:低剂量组;D:中剂量组;E:高剂量组未见优势反出现梗死体积变大
Figure 1 White infarct area by dose group A:no infarction in sham operation group;B:infarct volume in saline ischemia group;C:low dose group;D:middle dose group;E:high dose group has no advantage inverse infarct volume becomes larger
图2 各组Caveolin-1蛋白表达情况(n=5) A:M为Protein Ladder,A1~A5依次为假手术组、生理盐水缺血组、低剂量组、中剂量组及高剂量组,其中A2表达情况明显高于A3~A5;B:B1~B5依次为假手术组、生理盐水缺血组、低剂量组、中剂量组及高剂量组,B3~B5分别与B2两两相比,独立样本t检验,表达明显降低,**P<0.05
Figure 2 The expression of Caveolin-1 protein in each group (n=5) A:M is Protein Ladder,and A1-A5 are sham operation group,normal saline ischemia group,low dose group,middle dose group and high dose group.The expression of A2 was significantly higher than that of A3-A5;B:B1-B5 were sham operation group,normal saline ischemia group,low dose group,middle dose group and high dose group,and B3-B5 were compared with B2.Independent sample t test,the expression was significantly reduced,**P<0.05
表4 各组脑梗死体积百分比比较 (x±s)
Table 4 Comparison of percentage of brain infarct volume of each group (x±s)
注:各组与生理盐水缺血组相比,**P<0.01,##P>0.05;低与中剂量组分别与高剂量组相比,$P<0.0.5
图3 各组中微血管Caveolin-1蛋白表达情况(n=8) A:A1~A5依次为假手术组,生理盐水缺血组,低剂量组,中剂量组及高剂量组,其中生理盐水缺血组表达情况明显高于其他各组;B:B1~B5依次为假手术组,生理盐水缺血组,低剂量组,中剂量组及高剂量组
Figure 3 Expression of microvascular Caveolin-1 protein in each group (n=8) A:A1-A5 were sham operation group,normal saline ischemia group,low dose group,middle dose group and high dose group,in which saline deficiency The expression of blood group was significantly higher than that of other groups;B:B1-B5 were sham operation group,saline ischemia group,low dose group,middle dose group and high dose group
3 讨论
目前国际上对于中枢神经系统Caveolin-1的研究已经开展了多年,但对于脑I/R损伤后Caveolin-1的表达情况及Caveolin-1对BBB的作用和预后却得到了孑然相反的结论,GU等[8]以及SHEN等[7]发表的文章中阐述脑缺血再灌注后Caveolin-1表达降低,然而NAG等[14]研究证实在缺血缺氧后Caveolin-1的表达增加和JEAN-FRAN等[15]证实大鼠脑MCAO模型后Caveolin-1表达大幅度增加。针对这一现象,研究中给以大鼠MCAO模型,通过免疫组化及Western Blot两种蛋白定量手段比较假手术组及生理盐水缺血组的缺血半球皮层微血管段及皮层区Caveolin-1表达,发现在脑缺血2 h再灌注24 h损伤后的大鼠脑内的其表达明显增加,并将Western Blot检测的时间点延续至缺血2 h再灌注48 h、72 h及1周发现,缺血后Caveolin-1表达持续增加与48 h达高峰,随后的72 h及1周表达量逐渐下降,选取脑梗死中心组织均定位于同组TTC实验中呈现白色的梗死部位,即梗死侧半球中后1/3的皮层。对于本研究结论与已有报道中矛盾部分,可能是由于实验条件不同,如大鼠的年龄、缺血持续的时间、实验的免疫分析中对整个缺血半球或者仅对缺血中心的组织进行匀浆等原因。
HMG-CoA还原酶抑制剂是一类强效降胆固醇药物,具有安全性高、耐受性好等优点。大量实验和临床研究表明,他汀具有调控血脂、稳定动脉粥样硬化斑块、预防卒中的复发等作用。以往研究中证实他汀能降低心血管内Caveolin-1的表达[16],这一过程可能与增加脑源性神经营养因子(BDNF)、血管内皮生长因子(VEGF)的表达有关,可以促进缺血后神经功能的恢复,但这一过程与血清胆固醇水平无关[17],目前颅内段血管的研究尚少。我们采用易通过血脑屏障的辛伐他汀给予大鼠预处理对比生理盐水缺血及假手术组,给以MCAO造模后对梗死中心蛋白定量。本研究证实与心血管内报告的结果一致,他汀类对神经系统中微血管内Caveolin-1表达同样抑制作用,其效果使脑缺血2 h再灌注24 h损伤中本应增加的Caveolin-1表达明显降低,甚至其抑制后的程度低于生理状态下,且3个剂量组两两对比发现,随给药剂量增加,Caveolin-1被抑制的水平也增加。
近年来,随着分子生物学进展,越来越多的证据说明TJ在BBB完整的结构及功能中扮演十分重要的角色,其构成包括结合黏连分子(junctional adhesion molecule,JAM)、ccludin、claudin和ZO蛋白等。在I/R损伤中,BBB的开放途径之一即是由TJ介导的细胞旁路途径,一方面,SONG等研究指出在大鼠的脑缺血再灌注模型中已Caveolin-1能通过下调MMPs蛋白表达保护紧密连接蛋白,使用siRNA转染沉默Caveolin-1表达的大鼠脑BMECs中紧密连接蛋白会缺失、重排,导致血脑屏障通透性增加和单核细胞移动穿过BBB血管内皮结构[18];另一方面,NAG等[14]的研究表明,Caveolin-1会降低紧密连接蛋白的稳定性,导致其组分重排,并直接下调occludin、claudin和ZO-1等的表达[19]。在BBB的开放途径另一途径——跨细胞途径中,Caveolin-1的表达情况会直接作用于由其构成的Caveolae,Caveolae是跨细胞途径中主导的胞吞、胞饮和穿胞吞排作用的[3]重要膜结构。BBB通透性增加会加重脑水肿,这也是脑I/R损伤后脑损害的重要一环。生理状态下的BBB能够完全阻止大分子染料伊EB渗透进入脑组织,而在I/R损伤后,BBB的开放会使EB沿微血管管壁弥散进入脑组织。研究[20]证实,脑损害1 h内损害侧EB含量增加,24 h可达高峰。本研究使用干湿质量、EB通透性两种手段测定I/R损害后24 h梗死脑组织,评价不同组别的BBB破坏情况,证实假手术组BBB功能完好OD值远低于其他所有组,生理盐水缺血组BBB通透性最高,不同剂量给药组对BBB保护作用两两比较中,两种实验方法均证实中剂量组优于高剂量组,EB渗透实验中低剂量组优于中剂量组,这一现象与TTC实验的结果一致,即高剂量辛伐他汀组中Caveolin-1的表达被过度抑制,此过程会导致BBB的通透性增加。
4 结论
I/R中Caveolin-1蛋白的表达水平会增加,并影响BBB的通透性。在中枢神经系统中HMG-COA还原酶抑制剂对Caveolin-1的作用与其在心血管中的效果一致,能够有效降低Cavolin-1表达,且抑制程度与剂量水平相关。Caveolin-1过表达或低表达都会增加脑缺血再灌注后的损害,在MCAO中给予适当剂量辛伐他汀可以通过抑制过表达的Caveolin-1,保护血脑屏障完整,但过高或过低水平Caveolin-1蛋白都会破坏血脑屏障,增大梗死的体积,针对这一现象可以在缺血48 h内,有针对的,在其表达上升阶段,给以适量的他汀,适度降低Cavolin-1以减少脑损害。
本研究有针对性地面向国际相关文献中记载的矛盾部分设计实验,探索解决尚未解决的相关问题,可惜并未对Caveolin-1参与NO通路及藉由NO通路形成多通路串联中探讨Caveolin-1的角色,能说明的问题仍十分有限,对其作用机制仍有待进一步研究。
5 参考文献
[1] LOK J,GUPTA P,GUO S,et al.Cell-cell signaling in the neurovascular unit[J].Neurochem Res,2007,32(12):2 032-2 045.
[2] ABBOTT N J,RONNBACK L,HANSSON E.Astrocyte-endothelial interactions at the blood-brain barrier[J].Nat RevNeurosci,2006,7(1):41-53.
[3] PHILIPPE G,STEPHANOS P,LISANTI M P.Caveolae and transcy tosis in endothelial cells role in the roselerosis[J].Cell Tissue Res,2009,335(1):41-47.DOI:10.1007/s00441-008-0659-8.
[4] SCHUBERT W,FRANK PG,WOODMAN S E,et al.Microvascular hyperpermeability in Caveolin-1 (-/-) knockoutmice.Treatment with a specific nitric-oxide synthaseinhibitor,L-NAME,restores normal microvascularpermeability in Cav-1 null mice[J].Biol Chem,2002,277(42):40 091-40 098.
[5] JASMIN J F,MALHOTRA S,SINGH DHALLU M,et al.Caveolin-1 deficiency increases cerebral ischemic injury[J].Circ Res,2007,100(5):721-729.
[6] CHOW A K,CENA J,EL-YAZBI A F,et el.Caveolin-1 inhibits matrix metalloproteinase-2 activity in the heart[J].Mol Cell Cardiol,2007,42(4):896-901.
[7] SHEN J,MA S,CHAN P,et al.Nitric oxide down-regulates caveolin-1 expression in rat brains during focal cerebral ischemia and reperfusion injury[J].Neurochem,2006,96(4):1 078-1 089.
[8] GU Y,DEE CM,SHEN J.Interaction of free radicals,matrix metalloproteinases and caveolin-1 impacts blood-brain barrier permeability[J].Front Biosci,2011,7:1 216-1 231.
[9] GÜRSOY-OZDEMIR Y,BOLAY H,SARIBAŞ O,et al.Role of endothelial nitric oxide generation and peroxynitrite formation in reperfusion injury after focal cerebral ischemia[J].Stroke,2000,31(8):1 974-1 980;discussion 1981.
[10] GU Y,ZHENG G,XU M,et al.Caveolin-1 regulates nitric oxide-mediated matrix metalloproteinases activity and blood-brain barrier permeability in focal cerebral ischemia and reperfusion injury[J].Neurochem,2012,120(1):147-156.DOI:10.1111/j.1471-4159.2011.07542.x.
[11] LU F,CLARK P,et al.Reperfusion activates metalloproteinases that contribute to neurovascular injury[J].Exp Neurol,2008,210:549-559.
[12] CHANG D I,HOSOMI N,LUCERO J,et al.Activation systems for latent matrix metalloproteinase-2 are upregulated immediately after focal cerebral ischemia[J].Cereb Blood Flow Metab,2003,23(12):1 408-1 419.
[13] YANG Y,ESTRADA E Y,THOMPSON J F,et al.Matrix metalloproteinase-mediated disruption of tight junction proteins in cerebral vessels is reversed by synthetic matrix metalloproteinase inhibitor in focal ischemia in rat[J].Cereb Blood Flow Metab,2007,27(4):697-709.
[14] NAG S,VENUGOPALAN R,et al.Increased caveolin-1 expression precedes decreased expression of occluding and claudin-5 during blood-brain barrier breakdown[J].Acta Neuropathol (Berl),2007,114:459-469.
[15] JEAN-FRAN J,SAMIT M.Caveolin-1 Deficiency Increases Cerebral Ischemic Injury[J].Circ Res,2007,100:721-729.
[16] SHAOWEI L,YANPING H.Caveolin-1 restoration by cholesterol enhance the inhibitory effect of sivnvastatin on arginine vasopressin-induced cardiac fibroblasts proliferation[J].Mol Cell Biochem,2009,331:1-2.
[17] LEE S H,KIM Y H,KIM Y J.Atorvastatin enhances hypothermia-induced neuroprotection after stroke[J].Neurol Sci,2008,275(1/2):64-68.DOI:10.1016/j.jns.2008.07.029.
[18] SONG L,GE S,PACHTER J S,et al.Caveolin-1 regulates expression of junction-associated proteins in brain microvascular endothelial cells[J].Blood,2007,109(4):1 515-1 523.
[19] MCCAFFREY G,STAATZ W D,QUIGLEY C A,et al.Tight junctions contain oligomeric protein assembly critical for maintaining blood-brain barrier integrity in vivo[J].Neurochem,2007,103(6):2 540-2 555.DOI:10.1111/j.1471-4159.2007.04943.x.
[20] CLAUDE P.Morohhological factors influencing transpithelial permeability:a model for the resistance of the zonula occludins[J].J Membr Biol,1979,39(2/3):219-232.
(收稿2018-10-15)
本文责编:夏保军
本文引用信息:王也,冯新红,毕国荣,武剑.大鼠脑缺血再灌注损伤后HMG-COA还原酶抑制剂下调Caveolin-1表达对血脑屏障的影响[J].中国实用神经疾病杂志,2019,22(4):349-357.DOI:10.12083/SYSJ.2019.04.118
Reference information:WANG Ye,FENG Xinhong,BI Guorong,WU Jian.HMG-COA reductase inhibitor induced blood-brain barrier permeability decrease is mediated by downregulation of caveolin-1 protein after middle cerebral artery occlusion and reperfusion injury rats[J].Chinese Journal of Practical Nervous Diseases,2019,22(4):349-357.DOI:10.12083/SYSJ.2019.04.118