尿酸在脑梗死中的神经保护作用机制研究
莫志铭
广州医科大学附属第五医院,广东 广州 510000
doi:10.3969/j.issn.1673-5110.2017.24.003
基金项目:2016年广东省科技发展专项资金项目,编号:2016A030313609;2016年广东省医学科研基金项目,编号:A2016199;2016年广东省教育厅特色创新项目(自然科学),编号:2016KTSCX112
作者简介:莫志铭(1985-),硕士,主治医师。研究方向:脑血管病。Email:Z119890@163.com
【摘要】 目的 探讨尿酸在脑梗死中的具体作用机制。方法 应用HT22细胞构建氧糖剥夺(OGD)模型,加入不同浓度尿酸刺激,采用MTT检测细胞增殖,TUNEL法检测细胞凋亡,同时检测ROS的产生情况。进一步利用线栓法建立大鼠大脑中动脉栓塞模型(MCAO),并注射入合适浓度尿酸,检测脑组织缺损状况。结果 当用不同浓度尿酸作用于神经细胞时,450 μmol/L浓度以内的尿酸对细胞增殖影响并不显著,但1 000 μmol/L的尿酸却能显著抑制细胞的增殖。低浓度(50 μmol/L)尿酸无法改善OGD/复氧时细胞增殖、凋亡和ROS产生的变化,而合适浓度(300 μmol/L)尿酸能显著改善OGD/复氧时细胞的增殖和凋亡,同时减少ROS产生,不过高浓度(1 000 μmol/L)尿酸却能进一步下调细胞增殖能力,并且增强ROS产生。同时,尿酸能显著减轻MCAO模型中大鼠的脑组织损伤程度。结论 不同浓度尿酸应该具有不同作用,合适浓度的尿酸具有神经保护作用,此发现可为尿酸的临床治疗研究提供指导作用。
【关键词】 尿酸;脑梗死;神经保护作用;细胞增殖;大鼠
【中图分类号】 R-332 【文献标识码】 A 【文章编号】 1673-5110(2017)24-0013-05
Neuroprotective mechanism of uric acid in cerebral infarction
MO Zhiming
The Fifth Affiliated Hospital of Guangzhou Medical University,Guangzhou 510700,China
【Abstract】 Objective To explore the specific mechanism of uric acid in cerebral infarction.Methods Oxygen glucose deprivation (OGD) model was constructed using HT22 cells,and then the cells were stimulated with different concentrations of uric acid.The cell proliferation was detected by MTT,the apoptosis was detected by TUNEL method,and the production of ROS was detected at the same time.To establish the model of middle cerebral artery occlusion (MCAO) by using thread embolism method,and treated them with the appropriate concentration of uric acid to detect the brain tissue defect.Results Uric acid below 450μM did not have significant effect on proliferation of cells,but 1 000μmol/L uric acid significantly inhibited proliferation of cells.Uric acid at a low concentration (50 μmol/L) improved proliferation and apoptosis of cells,and ROS levels during OGD/reoxygenation;and a suitable concentration (300 μmol/L) of uric acid significantly improved proliferation and apoptosis of cells,and reduce ROS production during OGD/reoxygenation;but a high concentration (1 000 μmol/L) of uric acid further reduced proliferation of cells and enhance ROS production.At the same time,uric acid significantly reduced the level of brain tissue damage in MCAO model rats.Conclusion Therefore,different concentrations of uric acid have different effect,and suitable concentrations of uric acid have neuroprotective effects.This finding may provide guidance for study of the clinical value of uric acid.
【Key words】 Uric acid;Cerebral infarction;Protective effect;Cell proliferation;Rat
脑梗死(cerebral infarction,CI)占全部脑卒中的60%~80%,其病死率排在心肌梗死和癌症之后,居第3位[1]。近年来,虽然对脑缺血后脑损伤的病理生理机制的研究取得重大进步,但临床治疗策略的选择仍然有限。因此,探讨脑梗死的病理生理学机制,寻求有效的治疗手段是当前医学研究的热点和难点。
血清尿酸(serum uric acid,SUA)是人体血清中内源性和外源性嘌呤在黄嘌呤氧化酶作用下的代谢终产物,关于其与脑梗死的关系及其作用目前已有较多研究。临床研究认为,高尿酸血症可能与缺血性脑卒中的发生风险增加、不良预后及早期死亡有关[2-3]。但越来越多新的临床研究发现尿酸具有神经保护作用[4-7]。我们对中国人群的临床研究证明,血清尿酸适当升高有利于青年脑梗死患者的预后[4]。对于目前尿酸在脑梗死中相互矛盾的结果,Huang等[8]的研究发现,血尿酸水平与卒中病死率的关系呈浓度依赖性。因此,在脑梗死中不同浓度尿酸所起作用可能不同,甚至表现为截然相反的功能,但目前还缺失理论证明。本研究利用各种神经细胞构建氧糖剥夺模型(oxygen-glucose deprivation,OGD),并且在动物模型上进一步验证,从而全面系统的探讨不同浓度尿酸在脑梗死中的作用。
1 材料与方法
1.1 细胞培养 小鼠海马神经元细胞系HT22购自武汉大学保藏中心,细胞用含10%胎牛血清(FBS)、100 μnits/mL青霉素和100 μg/mL链霉素的DMEM高糖培养基,置于37 ℃、5% CO2的培养箱内培养。
1.2 氧糖剥夺模型构建 收集细胞,培养于无糖的Earle buffer中,置于氮气培养箱中(95% N2、3% CO2、2%O2)培养2 h。缺氧缺糖培养完毕后,置于正常培养条件中进行培养,并加入不同浓度尿酸进行处理。
1.3 细胞存活率实验 细胞存活率用MTT法进行检测。将细胞用0.25%胰蛋白酶消化5 min配成单个细胞悬液,用台盼蓝染色计数活细胞数目。调整好活细胞的浓度接种到96孔板,每个孔的体积为100 μL。在细胞培养箱中培养24 h后,每孔加入100 μL不同浓度的受测试样品,培养特定的时间以后,每孔加MTT溶液(5 mg/mL用PBS配制,pH=7.4)20 μL,继续孵育4 h后小心吸弃孔内培养上清液,每孔加150 μL DMSO,脱色摇床振荡10 min,使结晶物充分融解。选择490 nm波长,在酶联免疫监测仪上测定各孔光吸收值,计算细胞存活率,同时作图以求得半数抑制浓度(IC50)。
1.4 ROS生成量测定 DCFH-DA 荧光法是一种常见的检测细胞体系中 ROS生成量的方法。细胞经消化计数重悬于PBS溶液中,细胞密度1×106 cells/mL,加入10 μmol/L DCFH-DA探针标记细胞,37 ℃避光作用30 min后离心弃去上清液。PBS重悬密度保持1×106 cells/mL,细胞以100 μL/孔加入96孔板。设置酶标仪激发波长为485 nm发射波长为535 nm,检测荧光强度。
1.5 TUNEL和DAPI双染检测 在载玻片上培养的细胞用3.7%的甲醛固定10 min,加入含有0.1%的Triton X-100的PBS,然后分别在100 μL/well含有TdT酶反应液的Tunel反应液中培养1 h,在1 μg/mL的DAPI反应液中培养15 min,用PBS洗涤后在荧光显微镜(Nikon Eclipse 80i)下观察细胞的染色情况。
大鼠线栓法大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型制备
成年Sprague-Dawley (SD)大鼠 (体质量210~230 g)购自广州医科大学动物中心,并经本学校伦理委员会批准进行实验。大鼠取仰卧位,四肢自然固定于手术台上,剃去颈部体毛,充分暴露颈部手术区域,取右侧气管旁长约 2 cm 的与器官平行的纵行切口,逐层钝性分离皮肤、皮下组织、浅筋膜、深筋膜及肌肉后暴露颈部血管及迷走神经。为避免切插入线栓时出血,先在颈总动脉近心端打一活结,阻断颈总动脉血流。颈外动脉离颈总动脉分叉处约 1 cm处打2个死结,并从中间离断颈外动脉。将颈外动脉残端向下与颈内动脉呈一条直线,使线栓从颈外动脉残端插入至颈内动脉。当线栓插入颈内动脉约 2 cm 时可感受到阻力,说明线栓到达大脑中动脉开口处,已阻断大脑中动脉血流。将颈外动脉残端连同线栓一起结扎,以固定线栓;保护手术切口,维持大鼠体温。缺血2 h后小心拔出颈内动脉内的线栓,结扎颈外动脉残端,松开颈总动脉近心端的活结,恢复颈内动脉血流,即实现再灌注。 逐层缝合肌肉、皮下组织及皮肤,在室温下复苏。同时用Locke缓冲液配制尿酸,通过股静脉注射(16 mg/ kg)。
1.6 TTC染色 48 h后,10%水合氯醛麻醉,断头取脑,-20 ℃冰箱冷冻10 min(同时37 ℃预热TTC溶液,TTC溶液置于12孔培养板中,避光)。脑组织变冷后取出,刀片去除嗅球和脑干部分。自额极开始行1.5 mm厚连续冠状切片 5片。12孔板加入2 mL TTC溶液(37 ℃预热,0.1%)。脑片转入12孔板中 (每孔内一个脑切片),37 ℃恒温烤箱或水浴锅,避光 15 min。在玻璃培养皿(装有生理盐水)排列,正反面照相,背景为深色或黑色。
1.7 统计学分析 所有实验至少重复3次,所有数据均以均数±标准差(x±s)表示。以SPSS 13.0统计学软件处理数据。P<0.05为差异有统计学意义。
2 结果
2.1 高浓度尿酸能抑制神经细胞的增殖 虽然已有不少临床研究表明,尿酸具有神经保护作用,但目前关于其具体作用机制的研究还很少。首先检测不同浓度尿酸对HT22细胞增殖的影响,结果发现,当尿酸钠盐浓度在450 μmol/L以内时,其虽然能微弱下调细胞的增殖能力,但差异无统计学意义(P>0.05)(图1A)。但当尿酸钠盐浓度达到1 000 μmol/L(此时为过饱和溶液,有尿酸钠盐晶体存在)时,HT22细胞生长状态明显发生变化(图1B),且细胞的增殖能力显著下调,下降了40%左右(图1A),差异有统计学意义(P<0.05)。因此,高浓度尿酸确实不利于细胞的生长,具有毒性作用。
2.2 合理浓度尿酸能改善OGD条件下神经细胞的增殖和ROS水平 根据上述研究结果,挑选低浓度(50 μmol/L)、合适浓度(300 μmol/L,具有保护作用)和高浓度(1 000 μmol/L,具有损伤作用)尿酸进行后续研究。应用HT22细胞构建OGD模型,复氧的同时分别加入上述浓度尿酸钠盐进行培养。24 h后检测细胞增殖发现,OGD条件下细胞增殖能力明显下调,加入低浓度尿酸时,细胞增殖能力无明显改善;不过加入300 μmol/L尿酸时,细胞增殖能力明显增强,具有保护作用;而加入1 000 μmol/L尿酸时,其进一步降低细胞增殖能力(图2A)。上述结果说明,一定浓度尿酸确实具有细胞保护作用,而高浓度尿酸具有损伤作用。研究进一步检测不同浓度尿酸对ROS生成的影响作用。由图2B可见,OGD条件下,细胞确实产生大量ROS,而低浓度尿酸无法改善OGD条件下ROS的生成,但300 μmol/L尿酸却能明显降低OGD条件下ROS的生成量,而且也能减少正常细胞的ROS生成。但加入1 000 μmol/L尿酸时,其均能增加OGD和正常条件下细胞的ROS生成量。因此,只有当尿酸达到一定浓度水平时才能发挥神经保护作用,而过高浓度尿酸却又具有相反作用。
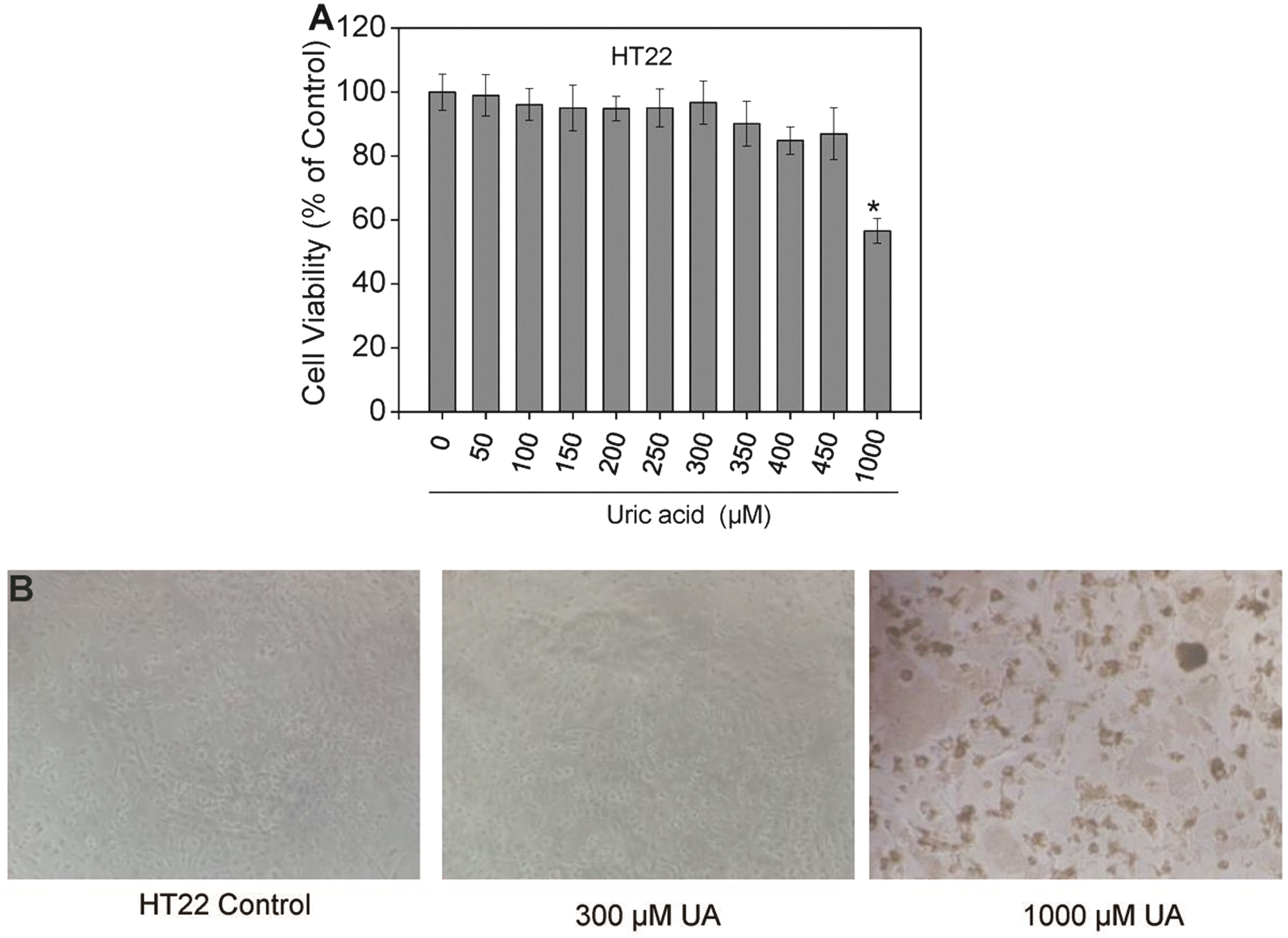
图1 不同浓度尿酸对HT22细胞增殖的影响
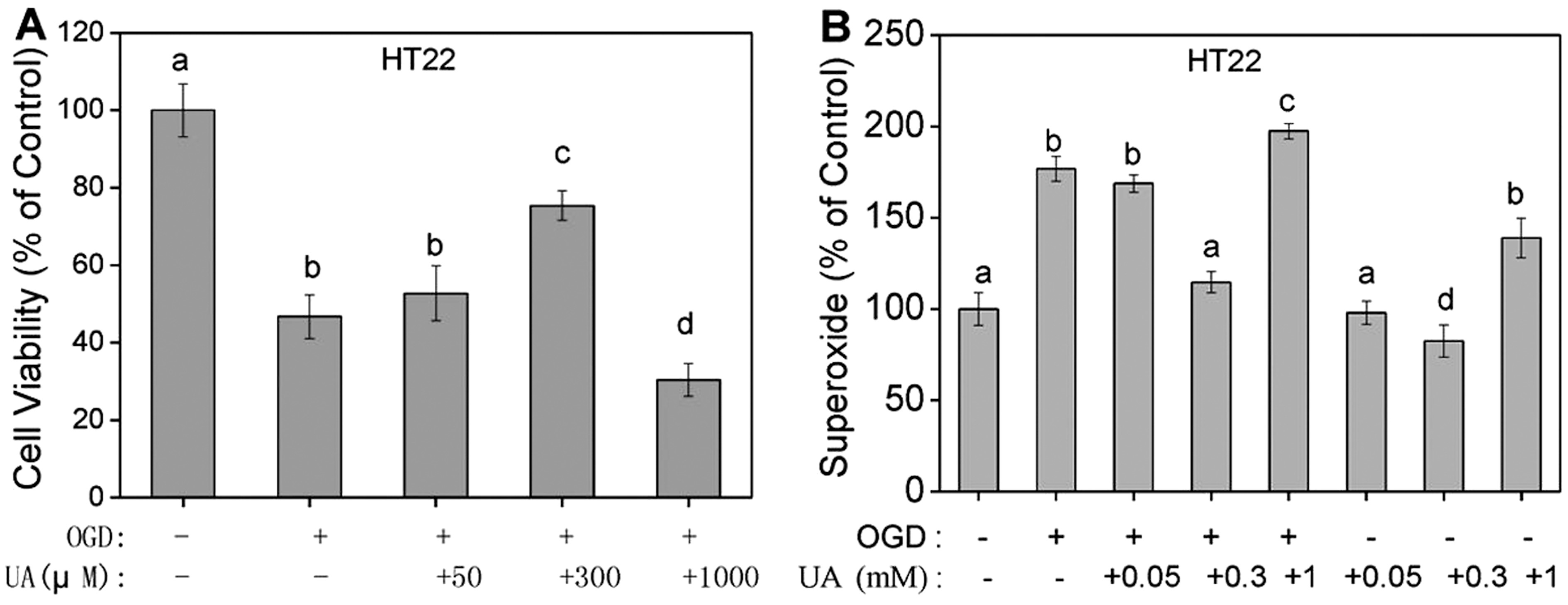
图2 不同浓度尿酸对OGD模型中HT22细胞增殖和ROS生成的影响
2.3 合理浓度尿酸能降低神经细胞的凋亡 进一步检测不同浓度尿酸对细胞凋亡的影响,结果见图3。OGD条件下,HT22细胞均出现明显凋亡,染成绿色的凋亡细胞显著增多。当加入300 μmol/L尿酸时,凋亡显著减少,差异明显;而50 μmol/L尿酸对OGD条件下细胞凋亡的改善并不显著。同时,当加入1 000 μmol/L尿酸时,细胞凋亡情况仍然明显。因此,上述结果进一步证明,合适浓度尿酸确实具有保护细胞而降低损失发生的作用,低浓度尿酸保护作用不明显,而高浓度尿酸确实具有损伤细胞的作用。
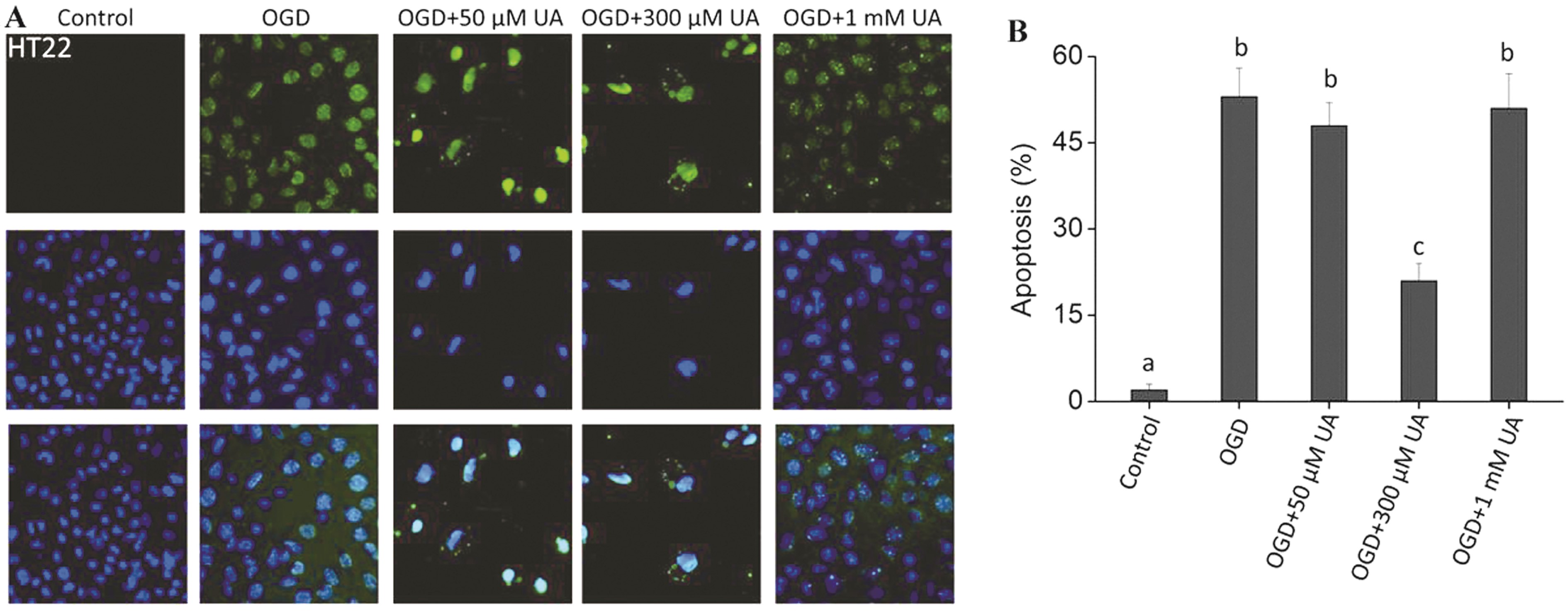
图3 不同浓度尿酸对OGD模型中HT22细胞凋亡的影响
2.4 合理浓度尿酸能减少脑梗死大鼠大脑损伤的发生 为了进一步证实尿酸的保护作用,我们在动物水平上进行验证。利用线栓法建立大鼠大脑中动脉栓塞模型(MCAO),结果表明,pMCAO组动物脑组织明显出现损伤,而加入合适浓度尿酸后,脑组织损伤程度明显减轻。因此,合适浓度尿酸确实可以减轻脑缺血再灌注损伤的发生。上述结果更进一步证明,合适浓度尿酸具有明显的神经保护作用,可以减轻损伤的发生。
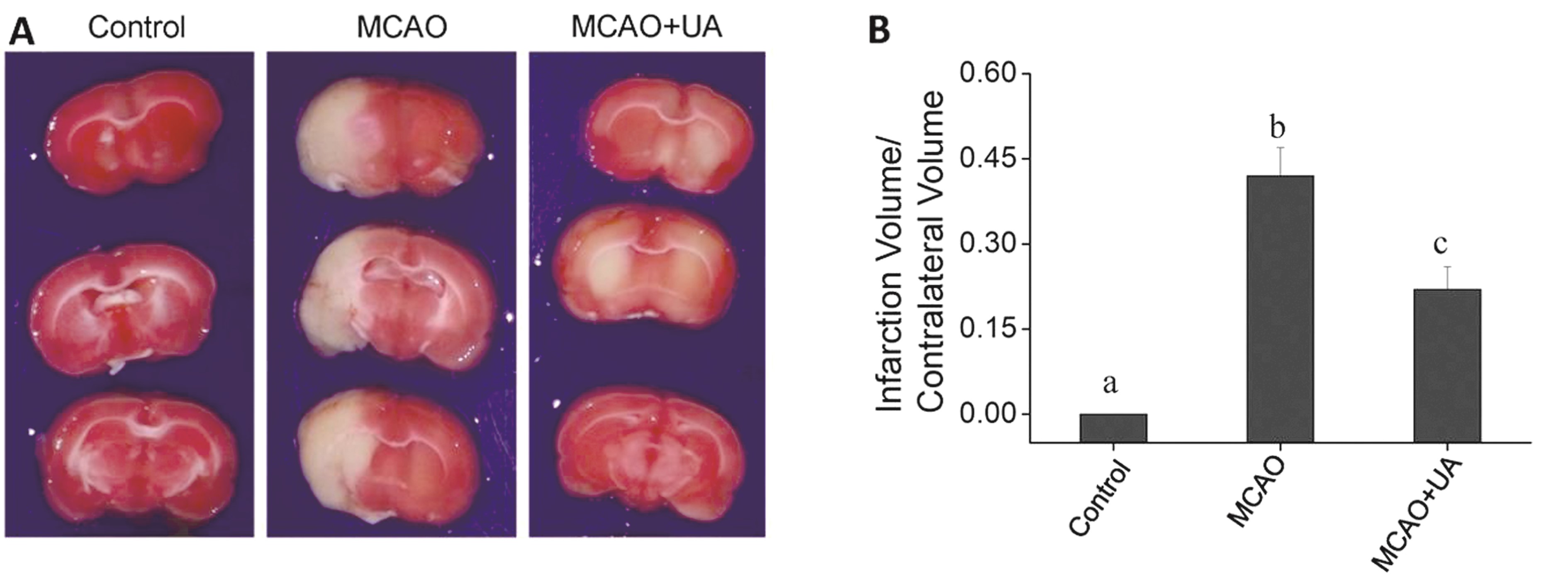
图4 尿酸对MCAO模型大鼠脑损伤的影响
3 讨论
缺血性脑血管病患病率、致残率和病死率高,是临床上常见的危害人类健康的三大疾病之一。缺血性脑血管病,尤其脑缺血后的再灌注损伤危害极大,预防和治疗脑缺血再灌注所造成的损伤是目前国内外研究的焦点。
虽然目前多数临床调查研究表明,SUA可作为有效的抗氧化剂和自由基清除剂,对急性缺血性脑卒中发挥神经保护作用[5-7]。但关于其作用的具体机制研究较少。当用不同浓度尿酸作用于神经细胞时,结果发现450 μmol/L浓度以内的尿酸对细胞增殖影响并不显著,但1 000 μmol/L的尿酸却能显著抑制细胞的增殖,这表明高浓度尿酸确实对细胞具有毒性。这与目前的临床调查研究结果相符,高尿酸有可能是脑梗死的致病因素。Conforti-Andreoni等[9]研究发现,尿酸晶体可以通过NF-κB通路激活树突状细胞产生细胞因子,从而诱导CD4+T细胞向Th17细胞分化,且此过程需要炎性体NLRP3介导的IL-1和IL-18参与。同时有研究发现,高浓度尿酸(高达50 mg/dL)可促进验证因子的产生[10]。上述研究均表明,高尿酸具有促进炎症发生的作用。
研究进一步表明,低浓度(50 μmol/L)尿酸无法改善OGD/复氧时细胞增殖的下调趋势,而合适浓度(300 μmol/L)尿酸具有明显的保护作用,能显著改善OGD/复氧时细胞的增殖能力,不过高浓度(1 000 μmol/L)尿酸却能进一步下调细胞增殖能力。上述结果进一步表明,高浓度尿酸具有损伤作用,而合适浓度尿酸具有保护作用。另外,很多研究证明ROS是组织缺血再灌注后最早和最重要的产物之一,在脑缺血损伤中起重要作用[11]。目前认为自由基毒性是急性脑梗死脑水肿形成和迟发性神经元死亡的主要原因[12]。自由基毒性是影响重型急性脑梗死预后的关键环节,因此清除包括ROS在内的氧自由基是治疗重型急性脑梗死的关键。研究进一步发现,低浓度尿酸无法改善OGD条件下ROS的生成,但300 μmol/L尿酸却能明显降低OGD条件下ROS的生成量,而且也能减少正常细胞的ROS生成。但加入1 000 μmol/L尿酸时,其均能增加OGD和正常条件下细胞的ROS生成量。因此,只有当尿酸达到一定浓度水平时才能发挥神经保护作用,而过高浓度尿酸却又具有相反作用。
对凋亡的检测也发现,当加入300 μmol/L尿酸时,凋亡显著减少,而50 μmol/L尿酸对OGD条件下细胞凋亡的改善并不显著;当加入1 000 μmol/L尿酸时,细胞凋亡情况仍然明显。利用线栓法建立大鼠持续性大脑中动脉栓塞模型(pMCAO),结果表明,pMCAO组动物脑组织明显出现损伤,而加入合适浓度尿酸后,脑组织损伤程度明显减轻。因此,合适浓度尿酸确实可以减轻脑缺血再灌注损伤的发生。人体血清中的尿酸不仅在含量上是其他内生性抗氧化物(如维生素C、维生素E等)10倍以上,且其抗氧化的性能也高于其他抗氧化物。研究显示,血尿酸主要依靠内生性抗氧化物的自动调节机制来抑制ROS产生,并通过保持细胞内钙离子水平平衡和稳定线粒体跨膜电位等途径而发挥对神经元细胞的保护作用[13]。正常水平的UA大约可清除血液中三分之二的自由基。当脑组织处于缺血状态时,黄嘌呤脱氢酶则转换为黄嘌呤氧化酶从而产生更多的UA。此时的UA作为可再生的抗氧化剂,具有清除自由基、减少氧化应激反应、保护缺血半暗带细胞免于缺血损伤的作用,可进一步缩小梗死灶体积[14]。Yu等[15]进行的动物实验表明在急性脑梗死早期或之后血尿酸浓度升高,可起到明显的保护可逆性神经功能缺损的作用。Amaro等[13]的研究发现,尿酸可以改善缺血性脑卒中患者中葡萄糖引起的氧化应激反应。因此,上述结果进一步证明,合适浓度尿酸确实具有保护细胞而降低损伤发生的作用,低浓度尿酸保护作用不明显,而高浓度尿酸确实具有损伤细胞的作用。
研究证明,合适浓度尿酸具有明显的神经保护作用,可以减轻损伤的发生,并且有可能通过抑制ROS产生而发挥作用。不过研究同时表明,高浓度尿酸具有损伤作用。此研究的进行,可为尿酸的临床治疗研究提供指导作用。
4 参考文献
[1] Cadilhac DA,Kim J,Lannin NA,et al.National stroke registries for monitoring and improving the quality of hospital care:A systematic review[J].Int J Stroke,2016,11(1):28-40.
[2] Hozawa A,Folsom AR,Ibrahim H,et al.Serum uric acid and risk of ischemic stroke:the ARIC Study[J].Atherosclerosis,2006,187(2):401-407.
[3] Heo SH,Lee SH.High levels of serum uric acid are associated with silent brain infarction[J].J Neurol Sci,2010,297(1-2):6-10.
[4] Zhang B,Gao C,Yang N,et al.Is elevated SUA associated with a worse outcome in young Chinese patients with acute cerebral ischemic stroke?[J].BMC Neurol,2010,10:82.
[5] Liu X,Liu M,Chen M,et al.Serum uric acid is neuroprotective in Chinese patients with acute ischemic stroke treated with intravenous recombinant tissue plasminogen activator[J].J Stroke Cerebrovasc Dis,2015,24(5):1 080-1 086.
[6] Li R,Huang C,Chen J,et al.The role of uric acid as a potential neuroprotectant in acute ischemic stroke:a review of literature[J].Neurol Sci,2015,36(7):1 097-1 103.
[7] Wang Z,Lin Y,Liu Y,et al.Serum Uric Acid Levels and Outcomes After Acute Ischemic Stroke[J].Mol Neurobiol,2016,53(3):1 753-1 759.
[8] Huang J,Hu D,Wang Y,et al.Dose-response relation-ship of serum uric acid levels with risk of stroke mortality[J].Atherosclerosis,2014,234(1):1-3.
[9] Conforti-Andreoni C,Spreafico R,Qian HL,et al.Uric acid-driven Th17 differentiation requires inflammasome-derived IL-1 and IL-18[J].J Immunol,2011,187(11):5 842-5 850.
[10] Crisan TO,Cleophas MC,Oosting M,et al.Soluble uric acid primes TLR-induced proinflammatory cytokine production by human primary cells via inhibition of IL-1Ra[J].Ann Rheum Dis,2016,75(4):755-762.
[11] Kahles T,Brandes RP.NADPH oxidases as therapeutic targets in ischemic stroke[J].Cell Mol Life Sci,2012 69(14):2 345-2 363.
[12] Li Q,Han X,Lan X,et al.Inhibition of tPA-induced hemorrhagic transformation involves adenosine A2b receptor activation after cerebral ischemia[J].Neurobiol Dis,2017,108:173-182.
[13] Amaro S,Llull L,Renú A,et al.Uric acid improves glucose-driven oxidative stress in human ischemic stroke[J].Ann Neurol,2015,77(5):775-783.
[14] Romanos E,Planas AM,Amaro S,et al.Uric acid reduces brain damage and improves the benefits of rt-PA in a rat model of thromboembolic stroke[J].J Cereb Blood Flow Metab,2007,27(1):14-20.
[15] Yu ZF,Bruce-Keller AJ,Goodman Y,et al.Uric acid protects neurons against excitotoxic and metabolic insults in cell culture,and against focal ischemic brain injury in vivo[J].J Neurosci Res,1998,53(5):613-625.
(收稿2017-07-12)
本文编辑:关慧
引用信息:莫志铭.尿酸在脑梗死中的神经保护作用机制研究[J].中国实用神经疾病杂志,2017,20(24):13-17.