目的 探讨磁共振弥散张量(DTI)及磁敏感加权成像(SWI)诊断早期原发性单侧症状帕金森病(PD)的价值。方法 纳入河南省人民医院2015-10—2017-11收治的早期原发性单侧症状PD患者40例,将其作为PD组,选取同期于体检的40例健康体检者为对照组。2组均接受磁共振DTI及SWI检查,比较PD组症状同侧、对侧以及对照组双侧感兴趣区的表观弥散系数(ADC值)、各向异性分数(FA值)、校正相位值(CP值),采用ROC曲线模型分析感兴趣区相关参数对早期原发性单侧症状PD的预测价值。结果 PD组症状
磁共振弥散张量及磁敏感加权成像对早期原发性单侧症状帕金森病的诊断价值
李东升1) 马建军1) 李 学1) 杜红妍1) 祁亚伟1) 申 磊2) 杜小静1)
河南省人民医院 1)神经内科 2)医学影像中心,河南 郑州 450003
基金项目:河南省医学科技攻关项目(201503164)
作者简介:李东升,Email:dongshengli2011@163.com
【摘要】 目的 探讨磁共振弥散张量(DTI)及磁敏感加权成像(SWI)诊断早期原发性单侧症状帕金森病(PD)的价值。方法 纳入河南省人民医院2015-10—2017-11收治的早期原发性单侧症状PD患者40例,将其作为PD组,选取同期于体检的40例健康体检者为对照组。2组均接受磁共振DTI及SWI检查,比较PD组症状同侧、对侧以及对照组双侧感兴趣区的表观弥散系数(ADC值)、各向异性分数(FA值)、校正相位值(CP值),采用ROC曲线模型分析感兴趣区相关参数对早期原发性单侧症状PD的预测价值。结果 PD组症状同侧、症状对侧壳核、黑质、丘脑、苍白球、红核的ADC值与对照组比较差异均无统计学意义(P>0.05)。PD组症状对侧的黑质FA值低于PD症状同侧与对照组,差异有统计学意义(P<0.05)。PD组症状对侧黑质CP值低于PD症状同侧与对照组,差异有统计学意义(P<0.05)。结论 在DTI及SWI检测的各参数中,黑质FA值、CP值对早期原发性单侧症状PD的诊断价值较高,可作为临床重点诊断指标。
【关键词】 原发性单侧症状帕金森病;磁共振;弥散张量成像;磁敏感加权成像;黑质
【中图分类号】 R742.5 【文献标识码】 A 【文章编号】 1673-5110(2018)19-2143-06 DOI:10.12083/SYSJ.2018.19.466
Diagnostic value of diffusion tensor imaging and susceptibility weighted imaging in early unilateral unilateral Parkinson's disease
LI Dongsheng1),MA Jianjun1),LI Xue1),DU Hongwei1),QI Yawei1),SHEN Lei1),DU Xiaojing1)
1) Department of Neurology,2) Medical Imaging Center,Henan Provincial People's Hospital,Zhengzhou 450003,China
【Abstract】 Objective To investigatethe value of magnetic resonance diffusion tensorimaging (DTI) and magnetic sensitive weighted imaging (SWI) in the early diagnosis of primary unilateral symptomatic Parkinson's disease (PD).Methods We recruited 40early primary unilateral symptom PD patients as PD group in our hospitalfrom October 2015 to November 2017.40 healthy persons who were examined in our hospital during the same period were selected as control group.The two groups were examined by magnetic resonance DTI and SWI.The apparent diffusion coefficient (ADC value),anisotropic fraction (FA value) and corrected phase value (CP value) of the bilateral areas of interest in the PD group were compared with those in the ipsilateral,contralateral and control groups.ROC curve model was used to analyze the predictive value of relative parameters of the areas of interest for early primary unilateral symptom PD.Results There were no statistically significant differences in the ADC value between putamen,substantia nigra,thalamus,globus pallidus and red nucleus of the ipsilateral symptoms and contralateral symptoms in group PD and those of the control group (P>0.05).The FA value of the contralateral substantia nigra in group PDwas lower than that of the symptomatic ipsilateraland the control group.There were statistically significant differences (P<0.05).The CP value of contralateral substantia nigra in group PD was lower than that of symptomatic ipsilateral and control group.There were statistically significant differences (P<0.05).Conclusion Among the parameters detected by DTI and SWI,the FA value and CP value of substantia nigra are the higher diagnostic value for early primary unilateral symptom PD,and can be used as the key clinical diagnostic criteria.
【Key words】 Primary unilateral symptoms Parkinson's disease;Magnetic resonance;Diffusion tensor imaging;Susceptibility weighted imaging;Substantia nigra
帕金森病(Parkinson’s disease,PD)以老年人居多,在40岁以下的人群中患病率较低,目前临床对于PD的具体发病机制尚未完全明确,但认为与遗传、氧化应激、年龄、线粒体功能障碍、α-突触核蛋白的异常表达和聚集、铁的异常沉积等因素相关。PD的临床症状包括行动迟缓、静止性震颤、肌强直等,中脑黑质多巴胺(dopamine,DA)能神经元缺失是其主要病理特征[1-2]。研究发现,PD早期病变大多表现为单侧肢体功能异常,随着病情进展可累及对侧[3]。目前,磁共振弥散张量(diffusion tensor imaging,DTI)及磁敏感加权成像(susceptibility weighted imaging,SWI)在神经系统疾病诊断中体现出多种优势,如能反映神经元状态,明确其缺失情况,一次扫描便能获得多个感兴趣区的检测数据,操作简单等。然而,目前临床对磁共振DTI及SWI诊断PD仍未形成一个统一标准,为了进一步了解PD患者的临床特征,本研究纳入40例早期原发性单侧症状PD患者为研究对象,分析磁共振DTI及SWI在其诊断中的应用价值,为PD的临床早期诊断提供依据。
1 资料与方法
1.1 一般资料 选取河南省人民医院2015-10—2017-11收治的40例早期原发性单侧症状PD患者为PD组,以同期体检的40例健康体检者为对照组。PD组男21例,女19例,年龄50~79(65.49±6.76)岁;左侧症状24例,右侧症状16例。对照组男18例,女22例,年龄46~78(63.49±7.13)岁。2组性别、年龄比较差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准。
1.2 纳入标准 (1)PD组符合国际运动障碍协会(MDS)2015年帕金森病诊断标准;(2)单侧症状PD患者,Hoehn-Yahr分级<2级,不伴认知障碍;(3)近1个月内未使用过多巴胺类、抗精神类药物;(4)签署知情同意书。
1.3 排除标准 (1)因感染、血管病变、代谢病变、肿瘤等因素导致的脑白质病理改变;(2)合并脑炎、脑外伤、脑血管疾病;(3)既往有精神障碍、认知障碍、痴呆史;(4)累及双侧的帕金森病患者。
1.4 方法 首先采用常规MRI扫描,仪器为MAGNETOM Verio型3.0T磁共振,层厚、间隔分别为5 mm、1 mm,分别行轴位T1WI(TE、TR分别为20 ms、2 000 ms)、轴位T2WI(TE、TR分别为101 ms、4 200 ms)、矢状位T2WI(TE、TR分别为101 ms、4 200 ms)扫描。DTI检查选择SE-EPI序列,间距、层厚分别为0 mm、2 mm,TE、TR分别为70 ms、6 800 ms。SWI成像采用高分辨率序列,翻转角30°,TR、TE分别为38 ms、25 ms,间距、层厚分别为0 mm、2 mm,空间分辨率为0.6 mm×0.5 mm×2.0 mm,矩阵为512×385。将所获取信息传送至后处理工作站,选择感兴趣区,包括壳核、黑质、丘脑、苍白球、红核,对感兴趣区的表观弥散系数(apparent diffusion coefficient,ADC值)、各向异性分数(fractional anisotropy,FA值)、校正相位值(corrected phase,CP值)进行测量,重复测量3次后取均值作为最终结果。
1.5 观察指标 观察PD组症状同侧、症状对侧以及对照组双侧壳核、黑质、丘脑、苍白球、红核的ADC、FA、CP值并进行比较。本研究中对照组仅取双侧各参数均值,原因在于正常者各感兴趣区左、右侧的ADC、FA、CP值非常接近,未见显著差异。通过绘制ROC曲线模型分析感兴趣区相关参数预测早期原发性单侧症状PD的曲线下面积、最佳截断值、敏感度与特异度。
1.6 统计学分析 采用SPSS 22.0统计学软件对数据进行处理,计数资料用百分率(%)表示,采用χ2检验,计量资料用均数±标准差(x±s)表示,3组比较采用单次测量方差分析,两两比较采用t检验,利用ROC曲线模型分析各参数对早期原发性单侧症状PD的预测价值,P<0.05为差异有统计学意义。
2 结果
2.1 2组感兴趣区的ADC值比较 PD组症状同侧、症状对侧各感兴趣区ADC值比较差异无统计学意义(P>0.05),PD组症状同侧、症状对侧各感兴趣区ADC值与对照组相比差异均无统计学意义(P>0.05)。见表1。
2.2 2组感兴趣区的FA值比较 PD组症状同侧、症状对侧壳核、丘脑、苍白球、红核FA值比较差异无统计学意义(P>0.05)。PD组症状对侧的黑质FA值低于PD症状同侧与对照组,差异有统计学意义(P<0.05),组间其他各指标比较差异无统计学意义(P>0.05)。见表2。
2.3 2组感兴趣区的CP值比较 PD组症状对侧黑质CP值低于症状同侧与对照组,差异有统计学意义(P<0.05),组间其他指标比较差异无统计学意义(P>0.05)。见表3。
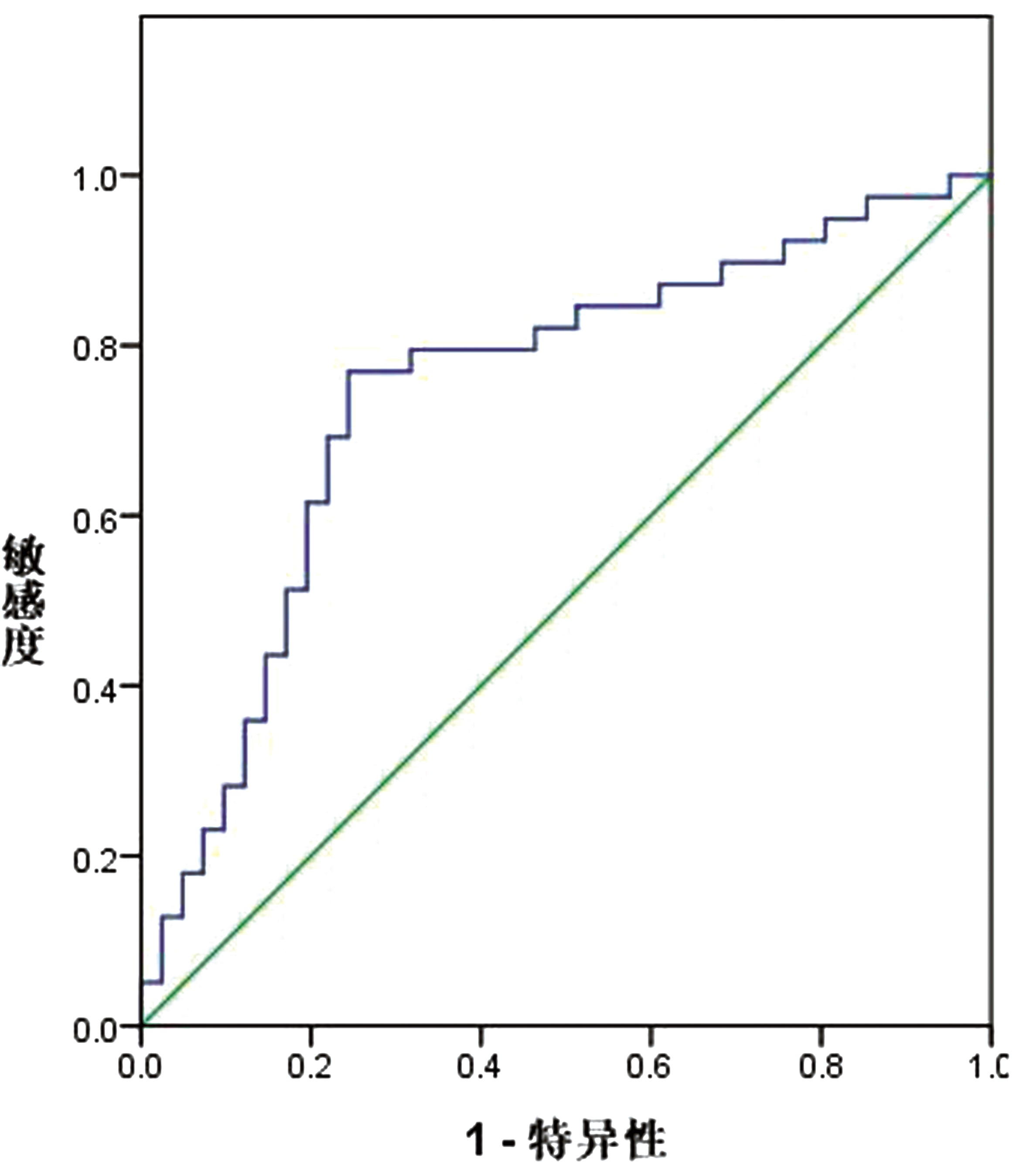
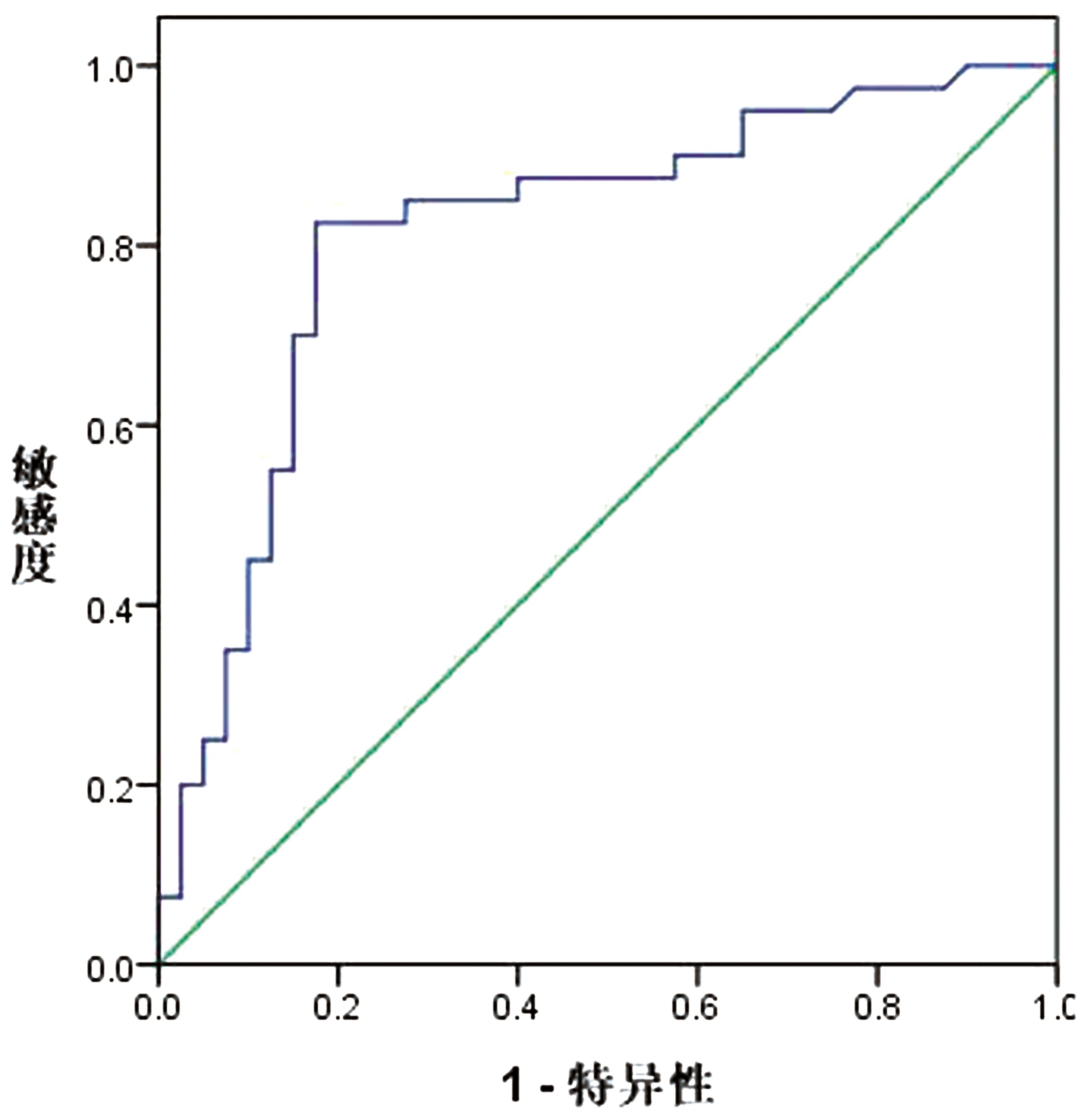
2.3 感兴趣区相关参数对早期原发性单侧症状 PD的预测价值以PD组症状对侧黑质的FA、CP值及对照组双侧黑质均值做ROC曲线模型,发现黑质FA值预测早期原发性单侧症状PD曲线下面积为0.745(95% CI=0.634~0.856,最佳截断值0.730,敏感度0.769,特异度0.756)。黑质CP值预测的曲线下面积为0.815(95% CI=0.717~0.913,最佳截断值0.794,敏感度0.800,特异度0.825)。见图1、图2。
表1 2组感兴趣区的ADC值比较 (x±s)
Table 1 Comparison of ADC values of regions of interest of 2 groups (x±s)
| 组别 |
n |
|
壳核 |
黑质 |
丘脑 |
苍白球 |
红核 |
| PD组 |
40 |
症状同侧 |
0.783±0.089 |
0.743±0.127 |
0.774±0.075 |
0.373±0.074 |
0.414±0.041 |
| |
|
症状对侧 |
0.754±0.085 |
0.741±0.149 |
0.775±0.067 |
0.375±0.072 |
0.415±0.042 |
| 对照组 |
40 |
双侧均值 |
0.759±0.056 |
0.793±0.105 |
0.769±0.073 |
0.381±0.068 |
0.430±0.061 |
| F值 |
|
|
1.578 |
2.11 |
0.08 |
0.136 |
1.345 |
| P值 |
|
|
0.211 |
0.126 |
0.923 |
0.873 |
0.264 |
| t1值 |
|
|
1.49 |
0.065 |
0.063 |
0.123 |
0.108 |
| P1值 |
|
|
0.14 |
0.949 |
0.95 |
0.903 |
0.915 |
| t2值 |
|
|
1.444 |
1.919 |
0.302 |
0.503 |
1.377 |
| P2值 |
|
|
0.153 |
0.059 |
0.763 |
0.616 |
0.173 |
| t3值 |
|
|
0.311 |
1.804 |
0.383 |
0.383 |
1.281 |
| P3值 |
|
|
0.757 |
0.075 |
0.703 |
0.703 |
0.204 |
注:t1、P1为PD组症状同侧与症状对侧比较;t2、P2为PD组症状同侧与对照组比较;t3、P3为PD组症状对侧与对照组比较
表2 2组感兴趣区的FA值比较 (x±s)
Table 2 Comparison of FA values of regions of interest of 2 groups (x±s)
| 组别 |
n |
|
壳核 |
黑质 |
丘脑 |
苍白球 |
红核 |
| PD组 |
40 |
症状同侧 |
0.331±0.042 |
0.556±0.082 |
0.342±0.031 |
0.376±0.085 |
0.414±0.042 |
| |
|
症状对侧 |
0.325±0.048 |
0.489±0.083 |
0.340±0.047 |
0.377±0.087 |
0.415±0.043 |
| 对照组 |
40 |
双侧均值 |
0.328±0.082 |
0.534±0.036 |
0.359±0.048 |
0.379±0.068 |
0.428±0.061 |
| F值 |
|
|
0.1 |
8.987 |
2.389 |
0.014 |
0.998 |
| P值 |
|
|
0.905 |
0 |
0.096 |
0.986 |
0.372 |
| t1值 |
|
|
0.595 |
3.632 |
0.225 |
0.052 |
0.105 |
| P1值 |
|
|
0.554 |
0.001 |
0.823 |
0.959 |
0.917 |
| t2值 |
|
|
0.206 |
1.554 |
1.882 |
0.174 |
1.196 |
| P2值 |
|
|
0.837 |
0.124 |
0.064 |
0.862 |
0.236 |
| t3值 |
|
|
0.2 |
3.146 |
1.789 |
0.115 |
1.102 |
| P3值 |
|
|
0.842 |
0.002 |
0.078 |
0.909 |
0.274 |
注:t1、P1为PD组症状同侧与症状对侧比较;t2、P2为PD组症状同侧与对照组比较;t3、P3为PD组症状对侧与对照组比较
表3 2组感兴趣区的CP值比较 (x±s)
Table 3 Comparison of CP values of regions of interest of 2 groups (x±s)
| 组别 |
n |
|
壳核 |
黑质 |
丘脑 |
苍白球 |
红核 |
| PD组 |
40 |
症状同侧 |
-0.068±0.012 |
-0.099±0.016 |
-0.058±0.010 |
-0.082±0.016 |
-0.085±0.030 |
| |
|
症状对侧 |
-0.069±0.011 |
-0.114±0.015 |
-0.059±0.012 |
-0.083±0.014 |
-0.086±0.029 |
| 对照组 |
40 |
双侧均值 |
-0.071±0.038 |
-0.098±0.014 |
-0.055±0.013 |
-0.077±0.032 |
-0.081±0.041 |
| F值 |
|
|
0.164 |
14.239 |
1.259 |
0.84 |
0.245 |
| P值 |
|
|
0.849 |
0 |
0.288 |
0.434 |
0.783 |
| t1值 |
|
|
0.389 |
4.326 |
0.405 |
0.297 |
0.152 |
| P1值 |
|
|
0.699 |
0 |
0.687 |
0.767 |
0.88 |
| t2值 |
|
|
0.476 |
0.297 |
1.157 |
0.884 |
0.498 |
| P2值 |
|
|
0.635 |
0.767 |
0.251 |
0.38 |
0.62 |
| t3值 |
|
|
0.32 |
4.932 |
1.43 |
1.086 |
0.63 |
| P3值 |
|
|
0.75 |
0 |
0.157 |
0.281 |
0.531 |
注:t1、P1为PD组症状同侧与症状对侧比较;t2、P2为PD组症状同侧与对照组比较;t3、P3为PD组症状对侧与对照组比较
图1 黑质FA值对早期原发性单侧症状PD的预测价值
Figure 1 Predictive value of substantia nigra FA value for early primary unilateral symptom PD
图2 黑质CP值对早期原发性单侧症状PD的预测价值
Figure 2 Predictive value of substantia nigra CP value for early primary unilateral symptomatic PD
3 讨论
研究发现,PD患者在典型症状发生前通常已出现神经病理异常改变,PD患者黑质致密部神经元缺失达到80%以前通常不出现临床运动症状,所以,早期发现PD的这种异常病理改变,有利于及时确诊病情,对改善PD预后有重要临床意义[4-8]。随着磁共振技术的进步,功能磁共振技术已广泛应用于临床疾病的诊断,DTI是主要利用人体内水分子在不同方向上自由运动所产生的信号成像,可及时发现灰质和脑白质微观结构变化,对组织结构、病理改变间的关系评价性较好,能明确白质纤维走行和纤维束的损害程度[9-12]。而SWI则是一种利用组织磁化敏感性的不同对比成像技术,其对脑内铁质沉积十分敏感,表现为低信号,在神经变性疾病中有广泛的的应用前景[13-15]。
本研究针对早期原发性单侧症状PD患者行DTI及SWI检查发现,症状对侧黑质FA值、CP值较同侧黑质、对照组显著下降,提示在PD早期已发生对侧黑质损害。FA值是较常用的各向异性量化指标,其变化与纤维致密性、髓鞘完整性等密切相关,纤维方向性越强,各向异性越高[16-19]。本次研究发现,PD组症状对侧黑质FA值明显低于正常人群(P<0.05),表明早期原发性单侧症状PD患者症状对侧纤维方向性较差,症状对侧黑质纹状体通路较同侧先受累,也说明早期PD患者黑质损害的不对称性,提示症状对侧黑质DA能神经元缺失量较多。CP值是反映脑内各核团铁含量的重要指标,铁蛋白破坏可导致大量铁离子的释放,促进自由基产生,导致神经元DNA性质改变,从而促进神经元的凋亡缺失[20-21]。PD组症状对侧黑质CP值低于症状同侧与对照组(P<0.05),提示早期原发性单侧症状PD患者的症状对侧黑质已存在铁的异常沉积,这可能是PD早期发病的一种重要病理损伤机制。
本研究发现,联合DTI及SWI对PD患者进行检查,便于发现原发性单侧症状PD患者黑质FA、CP的早期病理变化,及时发现早期可疑PD患者,从而可以客观地提供早期影像学依据。通过绘制ROC曲线模型发现在DTI及SWI的各参数中,黑质FA、CP值预测早期原发性单侧症状PD的曲线下面积均较大,敏感度和特异度也较高,对早期原发性单侧症状PD预测效果较理想。同时这种检查方法操作简单,适用性广,患者耐受性好,适合临床推广应用。但应注意以下问题:(1)在图像后处理过程中容易受人为因素影响,导致结果产生偏差;(2)因仪器型号、厂家等不同,可能导致结果出现一定差异。因此,联合DTI及SWI检查在早期原发性单侧症状PD诊断中具有较高价值,其中黑质FA、CP值能反映患者早期病变,可应用于PD的早期诊断。
4 参考文献
[1] KALINDERI K,BOSTANTJOPOULOU S,FIDANI L.The genetic background of Parkinson's disease:current progress and future prospects[J].Acta Neurol Scan,2016,134(5):314-326.
[2] HIRSCH L,JETTE N,FROLKIS A,et al.The Incide-nce of Parkinson's Disease:A Systematic Review and Meta-Analysis[J].Neuroepidemiology,2016,46(4):292-300.
[3] FRANCO-IBORRA S,VILA M,PERIER C.The Parkinson Disease Mitochondrial Hypothesis:Where Are We at?[J].Neuroscientist,2016,22(3):266-277.
[4] SURMEIER D J,OBESO J A,HALLIDAY G M.Selec-tive neuronal vulnerability in Parkinson disease[J].Nat Rev Neurosci,2017,18(2):101-113.
[5] GUAN J,RONG Y,WEN Y,et al.Detection and applicationof neurochemical profile by multiple regional 1H-MRS in Parkinson's disease[J].Brain Behav,2017,7(9):e00792.doi:10.1002/brb3.792.
[6] LI C,CHEN M,ZHAO X,et al.Chemical Exchange Saturation Transfer MRI Signal Loss of theSubstantia Nigra as an Imaging Biomarker to Evaluate the Diagnosis and Severityof Parkinson's Disease[J].Front Neurosci,2017,11:489.doi:10.3389/fnins.2017.00489.
[7] WANG J,YANG Q X,SUN X,et al.MRI evaluation of asymmetry ofnigrostriatal damage in the early stage of early-onset Parkinson's disease[J].Parkinsonism Relat Disord,2015,21(6):590-596.doi:10.1016/j.parkreldis.2015.03.012.
[8] BERARDELLI A,WENNING G K,ANTONINI A,et al.EFNS/MDS-ES/ENS[corrected]recommendations forthe diagnosis of Parkinson's disease[J].Eur J Neurol,2013,20(1):16-34.doi:10.1111/ene.12022.
[9] SIMON N G,LAGOPOULOS J,GALLAGHER T,et al.Peripheral nerve diffusion tensor imaging is reliable and reproducible[J].J Magn Reson Imaging,2016,43(4):962-969.
[10] LANGLEY J,HUDDLESTON D E,MERRITT M,et al.Diffusion tensor imaging of the substantia nigra in Parkinson's disease revisited[J].Hum Brain Mapp,2016,37(7):2 547-2 556.
[11] PAREKH M B,GURJARPADHYE A A,MANOUKIAN M A,et al.Recent developments in diffusion tensor imaging of brain[J].Radiol Open J,2015,1(1):1-12.
[12] KAMGATA K,TOMIYAMA H,HATANO T,et al.A preliminary diffusional kurtosis imaging study of Parkinson disease:comparison with conventional diffusion tensor imaging[J].Neuroradiology,2014,56(3):251-258.doi:10.1007/s00234-014-1327-1.
[13] KAKEDA S,KOYOGI Y,KAMADA K,et al.Signal intensity of the motor cortex on Phase-weighted imag-ing at 3T[J].AJNR Am J Neuroradiol,2008,29(6):1 171-1 175.
[14] WU S F,ZHU Z F,KONG Y,et al.Assessment of cerebral iron ccntent in patients with Parkinson's disease by the susceptibility-weighted MRI[J].Eur Rev Med Pharmacol Sci,2014,18:2 605-2 608.
[15] HALEFOGLU A M,YOUSEM D M.Susceptibility weighted imaging:Clinical applications and future directions[J].World J Radiol,2018,10(4):30-45.doi:10.4329/wjr.v10.i4.30.
[16] ZHAN W,KANG G A,GLASS G A,et al.Regional alterations of brain microstructure in Parkinson's disease using diffusion tensor imaging[J].Mov Disord,2012,27(1):90-97.
[17] ATKINSON-CLEMENT C,PINTO S,EUSEBIO A,et al.Diffusion tensor imaging in Parkinson's disease:Review and mete-analysis[J].Neuroimage Clin,2017,16:98-110.doi:10.1016/j.nicl.201707.011.
[18] SCHWARTZ S T,ABAEI M,GONTU V,et al.Diffusion tensor imaging of nigral degeneration in Parkinson's disease:A region-of-interest and voxel-based study at 3 T and systematic review with mete-analysis[J].Neurolmage Clin,2013,3:481-488.doi:10.1016/j.nicl.2013.10.006.
[19] POZORSKI V,OH J M,ADLURU N,et al.Longitud-inal white matter microstructural change in Parkinson's disease[J].Hum Brain Mapp,2018,39(10):4 150-4 161.doi:10.1002/hbm.24239.
[20] OALDEY A E,COLLINGWOOD J F,DOBSON J,et al.Individual dopaminergic neurons show raised iron levels in Parkinson disease[J].Neurology,2007,68(21):1 820-1 825.
[21] HUANG X M,SUN B,XUE Y J,et al.Susceptibility-weighted imaging in detecting brain iron accumulation of Parkinson's disease[J].Zhonghua Yi Xue Za Zhi,2010,90(43):3 054-3 058.
(收稿2018-07-22 修回2018-09-26)
本文责编:夏保军
本文引用信息:李东升,马建军,李学,杜红妍,祁亚伟,申磊,杜小静.磁共振弥散张量及磁敏感加权成像对早期原发性单侧症状帕金森病的诊断价值[J].中国实用神经疾病杂志,2018,21(19):2143-2148.DOI:10.12083/SYSJ.2018.19.466
Reference information:LI Dongsheng,MA Jianjun,LI Xue,DU Hongwei,YAN Yawei,SHEN Lei,DU Xiaojing.Diagnostic value of diffusion tensor imaging and susceptibility weighted imaging in early unilateral unilateral Parkinson's disease[J].Chinese Journal of Practical Nervous Diseases,2018,21(19):2143-2148.DOI:10.12083/SYSJ.2018.19.466