目的 研究携带人肝细胞生长因子基因的重组腺病毒(Ad-HGF)注入增龄及老龄脑动脉粥样硬化模型大鼠蛛网膜下腔后,HGF-TGF-β1平衡与增龄和动脉粥样硬化的关系。方法 正常SD大鼠160只,随机分为增龄组(1月组、6月组、12月组、1月Ad-HGF组、6月Ad-HGF组、12月Ad-HGF组)、造模组(模型组、模型Ad-HGF组),每亚组20只,分别于第10、20、30天抽取脑脊液,用ELISA试剂盒测定HGF和TGF-β1的浓度,应用Western blot检测各组不同时间脑组织HGF和TGF-β
外源性HGF对增龄和动脉硬化大鼠HGF和TGF-β1平衡的影响
赵晟昊 李 彤 王 凡
新乡医学院第一附属医院,河南 卫辉 453100
基金项目:省部共建项目(201401012)
作者简介:赵晟昊,住院医师,Email:294207743@qq.com
【摘要】 目的 研究携带人肝细胞生长因子基因的重组腺病毒(Ad-HGF)注入增龄及老龄脑动脉粥样硬化模型大鼠蛛网膜下腔后,HGF-TGF-β1平衡与增龄和动脉粥样硬化的关系。方法 正常SD大鼠160只,随机分为增龄组(1月组、6月组、12月组、1月Ad-HGF组、6月Ad-HGF组、12月Ad-HGF组)、造模组(模型组、模型Ad-HGF组),每亚组20只,分别于第10、20、30天抽取脑脊液,用ELISA试剂盒测定HGF和TGF-β1的浓度,应用Western blot检测各组不同时间脑组织HGF和TGF-β1的浓度。结果 未注射Ad-HGF的组别脑脊液中未检测到HGF,注射Ad-HGF的组别不同时间均可检测到人HGF。随着年龄增长脑脊液及脑组织中HGF含量逐渐降低,TGF-β1含量逐渐增加。造模组脑脊液及脑组织HGF含量较增龄组逐渐增加,TGF-β1含量逐渐降低(P<0.05)。结论 HGF与动脉硬化程度呈正相关,与年龄呈负相关;TGF-β1与动脉硬化程度呈负相关,与年龄呈正相关。HGF、TGF-β1水平随脑动脉硬化程度及年龄变化呈动态互逆平衡。
【关键词】 HGF-TGF-β1平衡;Ad-HGF;增龄;动脉硬化;脑卒中;大鼠
【中图分类号】 R-332 【文献标识码】 A 【文章编号】 1673-5110(2018)09-0935-07 DOI:10.12083/SYSJ.2018.09.236
Effects of exogenous HGF on the balance of HGF and TGF-beta 1 in aged rats and rats with atherosclerosis
ZHAO Shenghao,LI Tong,WANG Fan
The First Affiliated Hospital of Xinxiang Medical College,Weihui 453100,China
【Abstract】 Objective To study the carry person of hepatocyte growth factor gene recombinant adenovirus(Ad-HGF) injection increase of age and older,hyperlipidemia model rats after subarachnoid,HGF-TGF-beta 1 balance and the relationship between age and atherosclerosis.Methods 160 normal SD rats,in which age group(January and June,December and January Ad-June HGF group,Ad-HGF group,the December Ad-HGF group),module(model group,the model of Ad-HGF group),only in 10d,20d,30d extraction of cerebrospinal fluid,HGF was determined by ELISA kits and TGF-beta 1 concentration;Using Western blot test groups of different time of rats brain tissue HGF and TGF-the concentration of beta 1.Results No injection HGF was detected in cerebrospinal fluid in the Ad-HGF group,Ad-HGF group in different time can be detected on HGF.With increasing age HGF content in cerebrospinal fluid and brain tissue to reduce gradually,TGF-beta 1 content increased gradually.The HGF content in CSF and brain tissue increased gradually compared with that in the aging group,and the content of TGF beta 1 decreased gradually (P<0.05).Conclusion HGF is positively related with degree of hardening of the arteries,and negatively correlated with age;TGF-beta 1 is inversely associated with the degree of hardening of the arteries,and age is positively correlated.HGF,TGF-beta 1 level along with the degree of cerebral arteriosclerosis is dynamic inverse balance.HGF,TGF-beta 1 level changes with age in dynamic inverse balance.
【Key words】 HGF-TGF-beta 1 balance;Ad-HGF;Age;Atherosclerosis;Stroke;Rat
目前脑卒中已是中老年人的常见病与多发疾病,也是我国居民的第一大死亡原因以及首位致残因素[1-2]。脑动脉粥样硬化(cerebral atherosclerosis,CAS)是缺血性脑血管病的首要诱发因素,尤其弥漫性的小血管病变类型,目前无有效的治疗办法[3-4]。为多发性、弥漫性CAS所致的脑缺血寻找一个有效的治疗方法,以改变目前治疗方法少且效果差的现状,目前想到的是改变血运情况,但如何重建有效的血供是值得广大医学工作者深思的问题[5-6],从而为解决老龄化社会痴呆和脑梗死预防的难题打下基础。自从“基因治疗使心脏生成新血管”被列为美国心脏学会1998年度公布的十大研究项目之首,促血管生长细胞因子促血管新生的研究便成为医学领域关注的热点[7-8]。从2005年至今,《Nature》《Science》《Cell》等有关脑血管形成的分子机制研究始终引领本学科的前沿领域。诸多相关基因的功能与信号转导机制在胚胎脑血管发生中的发现,为成年脑血管新生机制的研究奠定了理论基础[9]。Ad-HGF目前已经进入临床Ⅲ期试验,并在心肌缺血和骨骼肌缺血治疗并获良好评价,目前,与HGF关系密切并具有明确相互作用的是TGF-β1[10-11]。
本实验通过向老龄CAS大鼠蛛网膜下腔中注入外源性Ad-HGF,观察其促脑血管新生的作用,采用ELISA法分析CAS大鼠脑脊液中HGF和TGF-β1含量,采用免疫组化和免疫印迹法分析脑组织中HGF和TGF-β1含量,探讨HGF、TGF-β1相互间作用关系与大鼠老龄和CAS的相关性。
1 材料和方法
1.1 主要材料 Ad-HGF(携带人HGF基因的重组腺病毒,滴度为5×109 pfu/100 μL,北京奥洛英),Westernblot试剂盒(碧云天),鼠抗HGF单克隆抗体,鼠抗TGF-β1单克隆抗体,Western blot试剂盒,人HGF及鼠TGF-β1的ELISA检测试剂盒(南京森贝伽),胆固醇、胆酸钠、丙基硫氧嘧啶、猪油、蛋黄粉、蔗糖(北京索莱宝),手术显微镜,大鼠脑立体定位仪,微型手持式颅钻,25 μL微量注射器,ML125鼠尾无创血压测定仪,Powerlab生理信号采集与处理系统(Powerlab/8SP Australia),奥林帕斯AU2700全自动生化分析仪。
1.2 动物模型建立 SPF级18月龄雄性SD大鼠30只,体质量300~400 g,购买于北京维通利华实验动物技术有限公司[动物生产许可证:SCXK(京)2012-0001,实验动物设施使用许可证:SYXK(豫)2014-0005],随机分为对照组(n=15)和脑动脉硬化模型组(CAS,n=15)。采用高血压合并高脂饲料喂养制备脑动脉硬化动物模型,造模方法按有关文献[12]处理,造模处理后凡血压较处理前高20 mmHg(1 mmHg=0.133 kPa)以上且高于115 mmHg认为形成高血压模型[13]。大鼠喂养16周后,模型组TC、TG、LDL-C水平均明显高于正常组,差异有统计学意义。模型组随机取大鼠5只,常规腹腔麻醉后,4%多聚甲醛磷酸盐缓冲液经心脏灌注后,断头取颈内动脉终段(约0.5 cm),制成石蜡切片并进行HE染色,光镜下观察颈内动脉血管病变。颈内血管形态学观察到血管内皮表面粗糙凹凸不平,细胞排列不规整,大量泡沫细胞堆积,血管内膜增厚显著,形成典型的AS斑快,提示CAS造模成功。
1.3 药物处理 建模成功后,另用40只造模大鼠随机分为模型组、模型Ad-HGF组各20只;模型Ad-HGF组20只大鼠5×109 pfu/mL,0.05 mL的Ad-HGF经小脑延髓池注射入蛛网膜下腔中。模型组大鼠20只,经小脑延髓池注入蛛网膜下腔注射0.05 mL生理盐水。1月龄雄性SD大鼠40只,随机抽取20只经小脑延髓池注入蛛网膜下腔中,注射5×109 pfu/mL,0.05 mL Ad-HGF。另取40只1月龄大鼠,随机抽取20只经小脑延髓池注入蛛网膜下腔5×109 pfu/mL,0.05 mL Ad-HGF,另外20只经小脑延髓池至蛛网膜下腔注射0.05 mL生理盐水。6月龄雄性SD大鼠40只,随机抽取20只经小脑延髓池注入蛛网膜下腔注射5×109 pfu/mL,0.05 mL Ad-HGF,另外20只经小脑延髓池注入蛛网膜下腔0.05 mL生理盐水。12月龄雄性SD大鼠40只,随机抽取20只经小脑延髓池至蛛网膜下腔注射5×109 pfu/mL,0.05 mL Ad-HGF,另外20只经小脑延髓池注入蛛网膜下腔0.05 mL生理盐水。
1.4 实验方法
1.4.1 ELISA法测定脑脊液中HGF和TGF-β1浓度
1.4.1.1 脑脊液的采集:将大鼠麻醉后,再将头部固定于立体定位仪上,头颈部剃毛、消毒干净后,用手术刀在后颈部作一3 cm纵向切口,轻轻分离颈部背侧的肌肉。术中及时止血,在暴露出枕骨大孔后。将大鼠头部压低,垂直由枕骨大孔向内进针抽取脑脊液,注意勿插入过深。抽完后缝好里面肌肉及外面皮肤,用干净纱布包扎伤口,防止感染。采集脑脊液后,应注入等量的生理盐水,以维持原有颅内的压力。最后将脑脊液移入1.5 mL的EP管中,放入液氮或干冰中迅速冷冻后移入-80 ℃中保存备用。
1.4.1.2 ELISA检测实验步骤:依试剂盒所提供的方法,严格进行ELISA检测。配置2 000、1 000、500、250、125、62.5、31.25 pg/mL的标准品各0.1 mL,每孔加入100 μL标准品或待测脑脊液。另设零孔2个,酶标板加上盖,37 ℃反应90 min。反应后用力甩尽酶标板内液体,再对着吸水纸拍几下,不洗。将准备好的生物素一抗工作液以每孔0.1 mL的标准依次加入(TMB空白显色孔除外)孔内,温箱内37 ℃下反应60 min。然后用PBS液洗涤酶标板3次,每次浸泡1 min以上。再用试剂盒中的ABC工作液按每孔0.1 mL的标准依次加入(TMB空白显色孔除外)各孔中,温箱内37 ℃下反应30 min,然后重复前面洗板工作。最后每孔依次加入等量的TMB显色液,温箱内37 ℃下避光反应30 min。最后每孔依次加入TMB终止液1滴并混匀,用酶标仪在450 nm处测吸光值OD。结果计算与判断:以零孔为对照,测得的数据以吸光值OD作为纵坐标,以浓度作为横坐标,在电脑中绘制出标准曲线,计算样品含量。
1.4.2 Western印迹检测:取-80 ℃冰箱内保存的各组大鼠的脑皮质,每组80 mg,用液氮研磨后分别加入蛋白裂解液后离心、取上清液,BCA法测定各组蛋白质浓度,每个样品上样80 μg,按总的蛋白质量计算各样品所需体积,需配平体积,再加入3倍Buffer煮沸5 min。再用10%的SDS-PAGE凝胶电泳分离蛋白,转移至PVDF膜上,使用5%脱脂奶粉室温封闭1 h,然后加入HGF或TGF-β1一抗,一抗浓度均为1:1 000,在4 ℃下孵育过夜。第2天室温下复温60 min,用TBST洗膜3次,每次10 min以后,加入对应的辣根过氧化物酶标记的二抗(浓度均为1:2 000),室温摇床上孵育2 h,再加入DAB显色液在凝胶成像系统中进行曝光和图像分析,用Image Q软件分析蛋白质条带,并计算出各个条带的面积与灰度值大小,计算二者乘积为积分灰度值,取3次重复测定值的均数。
1.4.3 观察指标:采用ELISA法测定各组大鼠脑脊液中HGF、TGF-β1的动态变化。采用Western blotting测定各组大鼠脑组织中HGF、TGF-β1蛋白杂交条带,与内参进行相对密度扫描求OD值。
1.5 统计学处理 应用SPSS 21.0统计软件进行统计学分析,对于符合方差分析应用条件的,组间均数比较采用单因素方差分析,组间多重比较采用最小显著性差异(LSD)检验;不满足方差分析条件时,组间多重比较采用Dunnett’s T3检验。假设检验统一使用双侧检验,以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 脑脊液中HGF、TGF-β1浓度 未打入Ad-HGF组大鼠脑脊液中均未检测到HGF,打入Ad-HGF组可在脑脊液中可检测到HGF浓度。经Dunnett’s T3法组间多重比较,打入Ad-HGF组脑脊液HGF浓度值均高于未打入Ad-HGF组,差异均有统计学意义(P<0.05),脑脊液HGF浓度值随年龄增加而降低,脑脊液HGF浓度值未打入Ad-HGF组间比较差异无统计学意义,打入Ad-HGF组间比较差异无统计学意义(P<0.05)。见表1。
表1 不同时间点各组大鼠脑脊液HGF浓度比较 (x±s,ng/mL)
| 组别 |
n |
10 d |
20 d |
30 d |
| 1月组 |
7 |
0.000±0.000 |
0.000±0.000 |
0.000±0.000 |
| 6月组 |
8 |
0.000±0.000 |
0.000±0.000 |
0.000±0.000 |
| 12月组 |
10 |
0.000±0.000 |
0.000±0.000 |
0.000±0.000 |
| 1月Ad-HGF组 |
9 |
1.622±0.041 |
0.510±0.037 |
0.289±0.009 |
| 6月Ad-HGF组 |
8 |
1.620±0.039 |
0.501±0.044 |
0.279±0.007 |
| 12月Ad-HGF组 |
9 |
1.618±0.038 |
0.500±0.036 |
0.278±0.008 |
| 模型组 |
10 |
0.000±0.000 |
0.000±0.000 |
0.000±0.000 |
| 模型Ad-HGF组 |
8 |
1.623±0.042 |
0.513±0.039 |
0.290±0.010 |
经Dunnett’s T3法组间多重比较,打入Ad-HGF的组别脑脊液TGF-β1浓度值均高于未打入Ad-HGF的组别,差异均有统计学意义(P<0.05);脑脊液TGF-β1浓度值随年龄增加而增加,各组内不同时间比较,经one way ANOVA分析,未打入Ad-HGF的组别脑脊液TGF-β1浓度值随时间变化差异无统计学意义,3个年龄Ad-HGF组脑脊液TGF-β1浓度值随时间变化差异有统计学意义,经LSD法组间多重比较,TGF-β1浓度第20天组低于第10天和第30天组(表2)。
表2 不同时间点各组大鼠脑脊液TGF-β1浓度比较 (x±s,pg/mL)
| 组别 |
n |
10 d |
20 d |
30 d |
| 1月组 |
8 |
162.45±39.412 |
162.49±39.414 |
162.43±39.411 |
| 6月组 |
8 |
175.12±44.125 |
175.15±44.124 |
175.17±44.123 |
| 12月组 |
9 |
199.45±49.245 |
199.50±49.247 |
199.57±49.251 |
| 1月Ad-HGF组 |
9 |
44.126±10.124 |
33.145±8.145 |
39.457±9.147 |
| 6月Ad-HGF组 |
8 |
51.456±11.451 |
40.789±10.012 |
45.123±11.456 |
| 12月Ad-HGF组 |
9 |
62.412±14.152 |
51.451±12.012 |
56.124±13.454 |
| 模型组 |
10 |
517.35±47.49 |
531.67±51.41 |
545.24±47.79 |
| 模型Ad-HGF组 |
8 |
336.80±18.26 |
266.47±26.14 |
317.12±17.49 |
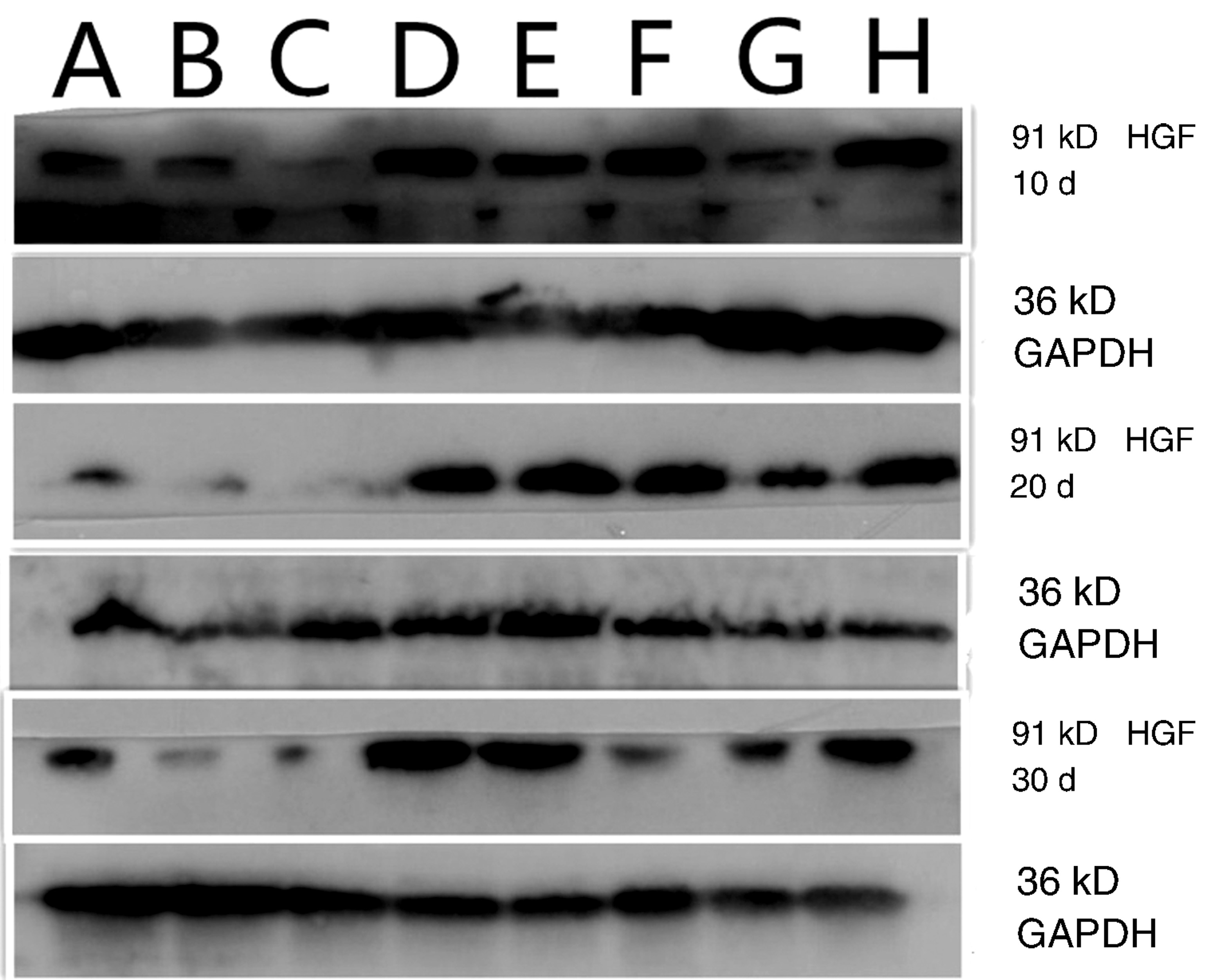
2.2 Western blotting法检测脑组织HGF、TGF-β1蛋白表达 未打入Ad-HGF的组别大鼠脑组织中只有较少HGF表达,打入Ad-HGF的组别脑组织可见HGF表达增多,同一时间点打入Ad-HGF的组别均较未打入Ad-HGF的组别有明显增加。经Dunnett’s T3法组间多重比较,未打入Ad-HGF的模型组HGF OD值高于未打入Ad-HGF的增龄组,差异无统计学意义(P>0.05)。打入Ad-HGF的增龄组HGF值随年龄增加而降低,经LSD法组间多重比较,第20天组高于第10天和第30天组(图1,表3)。
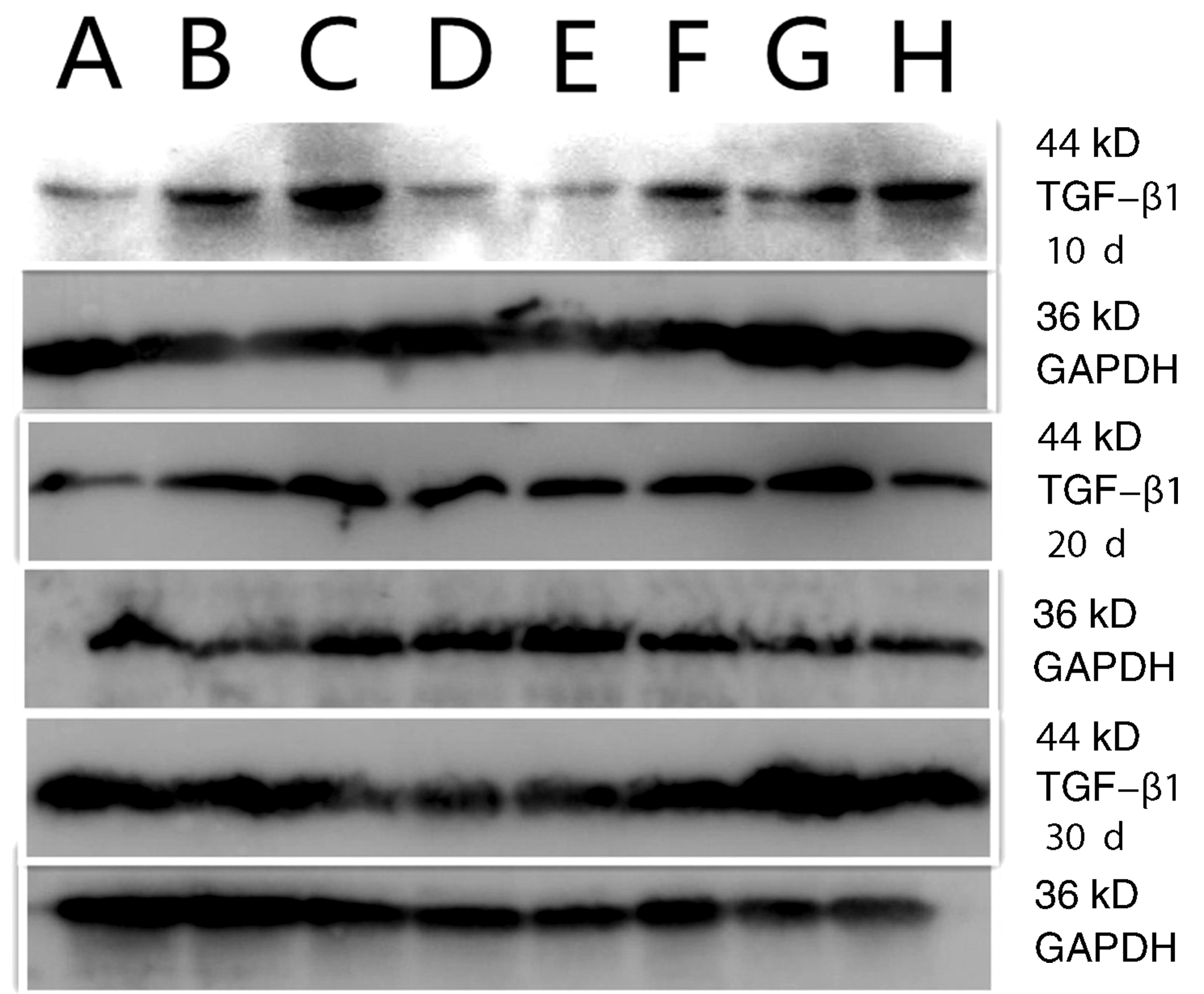
未打入Ad-HGF增龄组大鼠脑组织中TGF-β1表达较少,但在未打入Ad-HGF的模型组大鼠脑组织中TGF-β1明显增加。打入Ad-HGF组脑组织可见TGF-β1表达减少。TGF-β1 OD值随年龄的增加呈正相关(表4)。各组内不同时间之间比较,经one way ANOVA分析,未打入Ad-HGF增龄组大鼠脑组织中TGF-β1 OD值随时间变化无差异,未打入Ad-HGF的模型组和3个年龄Ad-HGF组脑组织中TGF-β1 OD值随时间变化有差异,经LSD法组间多重比较,第20天组低于第10天和第30天组(P<0.05,图2,表4)。
表3 不同时间点各组大鼠脑组织中HGF OD值比较 (x±s)
| 组别 |
n |
10 d |
20 d |
30 d |
| 1月组 |
7 |
0.031±0.008 |
0.031±0.008 |
0.031±0.008 |
| 6月组 |
8 |
0.022±0.007 |
0.022±0.007 |
0.022±0.007 |
| 12月组 |
10 |
0.016±0.006 |
0.016±0.006 |
0.016±0.006 |
| 1月Ad-HGF组 |
9 |
0.358±0.035 |
0.425±0.042 |
0.408±0.040 |
| 6月Ad-HGF组 |
8 |
0.327±0.032 |
0.397±0.036 |
0.381±0.038 |
| 12月Ad-HGF组 |
9 |
0.304±0.038 |
0.368±0.036 |
0.341±0.034 |
| 模型组 |
10 |
0.148±0.013 |
0.154±0.014 |
0.157±0.015 |
| 模型Ad-HGF组 |
8 |
0.468±0.024 |
0.534±0.050 |
0.520±0.037 |
表4 不同时间点各组大鼠脑组织中TGF-β1 OD值比较 (x±s)
| 组别 |
n |
10 d |
20 d |
30 d |
| 1月组 |
8 |
0.235±0.013 |
0.239±0.012 |
0.241±0.011 |
| 6月组 |
8 |
0.256±0.016 |
0.262±0.014 |
0.264±0.012 |
| 12月组 |
9 |
0.278±0.018 |
0.284±0.013 |
0.285±0.009 |
| 1月Ad-HGF组 |
9 |
0.204±0.009 |
0.184±0.008 |
0.192±0.009 |
| 6月Ad-HGF组 |
8 |
0.213±0.009 |
0.196±0.008 |
0.203±0.009 |
| 12月Ad-HGF组 |
9 |
0.221±0.010 |
0.201±0.009 |
0.210±0.011 |
| 模型组 |
10 |
1.355±0.018 |
1.433±0.022 |
1.530±0.030 |
| 模型TAd-HGF组 |
8 |
1.230±0.007 |
0.986±0.005 |
1.007±0.008 |
图1 Western blotting HGF蛋白表达 A:1月组;B:6月组;C:12月组;D:1月Ad-HGF组;E:6月Ad-HGF组;F:12月Ad-HGF组;G:模型组;H:模型Ad-HGF组
图2 Western blotting TGF-β1蛋白表达 A:1月组;B:6月组;C:12月组;D:1月Ad-HGF组;E:6月Ad-HGF组;F:12月Ad-HGF组;G:模型组;H:模型Ad-HGF组
3 讨论
本实验将外源性HGF打入3组增龄大鼠组,发现随着年龄的增加,HGF水平逐渐降低,随年龄增加,TGF-β1水平逐渐升高。而将外源性HGF打入老龄脑动脉粥样硬化模型大鼠后,随着动脉硬化程度加深,机体内HGF水平逐渐增加,TGF-β1水平却逐渐降低。说明HGF与动脉硬化程度呈正相关,与年龄呈负相关,TGF-β1与动脉硬化程度呈负相关,与年龄呈正相关。HGF、TGF-β1水平随年龄变化呈动态互逆平衡,HGF、TGF-β1水平随脑动脉硬化程度呈动态互逆平衡。
HGF 的快速诱导表达在遥远的完整器官中很常见,如肝、肾、肺、脾,以及在受伤在大鼠缺血再灌注损伤后的心及大脑中[14],表明内源性HGF可能来自这些器官。在肝、肾损伤大鼠血浆中,也有体液因子诱导HGF的表达[15]。转化生长因子β1可以由急性和慢性脑损伤引起,包括卒中、外伤、癫痫、多发性硬化症和阿尔茨海默病[16]。转化生长因子β1在不同类型的脑损伤中表达是不一样的,不同类型脑损伤时,TGF-β1有不同对应:卒中时TGF-β1的mRNA至少升高1周以上,明确发挥保护神经细胞的作用[17]。有文献报道,卒中时TGF-β1过度表达[18-20];当TGFβ信号被阻断,缺血损害加剧[21]。因此,它可能是一种有效的卒中治疗剂。
HGF、TGF-β1之间相互的平衡,参与确定的慢性器官疾病的预后,如脑梗死、肝硬化、肾硬化和肺纤维化[22-23]。在慢性疾病的早期阶段,HGF生产增强抑制TGF-β1产生。一般来说,HGF只在细胞再生和抗肝纤维化事件中作为代偿反应发生[24-25]。相比之下,在晚期TGF-β1表达的上调抑制HGF的表达[26]。在TGF-β1占主导地位的条件下,容易导致器官纤维化的发生和器官发展为功能障碍。为扭转这种不利的平衡,根据这种发病机制,所以用HGF治疗器官的功能衰竭以及纤维化(及增生)应视为一种新策略[27-29]。
本实验通过建立增龄及动脉硬化模型大鼠实验,探讨了脑组织和脑脊液中HGF和TGF-β1含量变化与年龄以及动脉硬化的关系,初步显示HGF-TGF-β1平衡在老龄以及脑动脉硬化发生、发展中的神经保护和血管形成过程中的作用,明确外源性Ad-HGF应用于中枢神经系统的有效性和不良反应。本实验对Ad-HGF应用于脑动脉硬化临床提供了科学依据,对脑血管病的防治提供了一种新的治疗方法和研究方向,也为神经康复治疗提供一个新途径。
4 参考文献
[1] SHEN C Y,TANG L C,LI Y T.Epidemiological investigation and risk factors of cerebral apoplexy in young and middle-aged population in western Guangdong[J].J Guangdong Med Coll,2015,4:42-44.
[2] LUO J,HO P P,BUCKWALTER M S,et al.Glia-dependent TGF-beta signaling,acting independently of the TH17 pathway,is critical for initiation of murine autoimmune encephalomyelitis[J].J Clin Invest,2007,117(11):3 306-3 315.
[3] TOMIC G,STOJANOVIC M,PAVLOVIC A.Speech and language disorders secondary to diffuse subcortical vascular lesion:Neurolinguistic and acoustic analysis.A case report[J].J Neurologic Sci,2009,283(1/2):163-169.
[4] POORTHUIS M H F,LGRAAM M D,ALGRA A,et al.Female-and Male-Specific Risk Factors for Stroke A Systematic Review and Meta-analysis[J].JAMA Neurol,2017,74(1):75-81.
[5] CARR K R,ZUCKERMAN S L,MOCCO J,et al.Inflammation,Cerebral Vasospasm,and Evolving Theories of Delayed Cerebral Ischemia[J].Neurol Res Int,2013,6:12.
[6] LI M,PENG T,SHI X,et al.Applied anatomic study and three-dimension reconstruction of the blood supply of pancreatic head[J].Chin J Clin Anat,2014,8:15-17.
[7] SHIMAMURA M,NAKAGAMI H,TANIYAMA Y,et al.Gene therapy for peripheral arterial disease[J].Exp Opin Biol Ther,2014,14(8):1 175-1 184.
[8] KAMINSKY S M,ROSENGARTT K,ROSENBERG J,et al.Gene Therapy to Stimulate Angiogenesis to Treat Diffuse Coronary Artery Disease[J].Human Gene Ther,2013,24(11):948-963.
[9] CARMELIET P,JAIN R K.Molecular mechanisms and clinical applications of angiogenesis[J].Nature,2011,473(7 347):298-307.
[10] NAKAMURA T,MIZUNO S.The discovery of hepatocyte growth factor (HGF) and its significance for cell biology,life sciences and clinical medicine[J].Proc Jpn Acad Ser B Phys Biol Sci,2010,86(6):588-610.
[11] MULLEN A C,ORLANDO D A,NEWMAN J J,et al.Master transcription factors determine cell-type-specific responses to TGF-β signaling[J].Cell,2011,147(3):565-576.
[12] 申冠洋,宋志秀,常利,等.肝细胞生长因子、TGF-β1含量与脑动脉粥样硬化程度关系[J].中国动脉硬化杂志,2014,22(3):269-273.
[13] 药红梅,吕吉元.几种冠状动脉粥样硬化大鼠模型建立方法比较[J].中西医结合心脑血管病杂志,2011,4(9):450-451.
[14] YILDIZ Y,SOKMENSUER C,YALCIN S.Evaluation of c-Met,HGF,and HER-2 expressions in gastric carcinoma and their association with other clinicopathological factors[J].Onco Targets Ther,2016,9:5 809-5 817.
[15] COTA B D C V,LIMA K S,MORAD A M.Expression of the c-MET,HGF and VEGF biomarkers in intes-tinal and diffuse gastric cancer in the Brazilian population:a pilot study for the standardization of the quantitative PCR technique[J].Appl Cancer Res,2017,37(1):18.
[16] BUCKWALTER M,WYSS-CORAY T.Modelling neu-roinflammatory phenotypes invivo[J].J Neuroinflammation,2004,1:10.
[17] SUGIMOTO K,NISHIOKA R,IKEDA A,et al.Activated microglia in a rat stroke model express NG2 proteoglycan in peri-infarct tissue through the involvement of TGF-β1[J].Glia,2014,62(2):185.
[18] BUISSON A,LESNE S,DOCAGNE F,et al.Transforming growth factor-beta and ischemic brain injury[J].Cell Mol Neurobiol,2003,23(4/5):539-550.
[19] WANG S,YIN J,GE M,et al.Transforming growth-beta 1 contributes to isoflurane postconditioning against cerebral ischemia-reperfusion injury by regulating the c-Jun N-terminal kinase signaling pathway[J].Biomed Pharmacother,2016,78(2):280-290.
[20] MA M,MA Y,YI X,et al.Intranasal delivery of transforming growth factor-beta 1 in mice after stroke reduces infarct volume and increases neurogenesis in the subventricular zone[J].BMC Neurosci,2008,9:117.
[21] YOO S W,CHANG D Y,LEE H S,et al.Immune following suppression mesenchymal stem cell transplantation in the ischemic brain is mediated by TGF-β[J].Neurobiol Dis,2013,58:249-257.
[22] MIZUNO S,MATSUMOTO K,NAKAMURA T,et al.Hepatocyte growth factor suppresses interstitial fibrosis in a mouse model of obstructive enephropathy[J].Kidney Int,2001,59(4):1 304-1 314.
[23] GIEBELER A,BOEKSCHOTEN M V,KLEIN C,et al.c-Meconfers protection against chronic liver tissue damage and fibrosis progression after bile duct ligation in mice[J].Gastroenterology,2009,137(1):297-308.
[24] LIN Y,FANG Z P,LIU H J,et al.HGF/R-spondin1 rescues liver dysfunction through the induction of Lgr5+ liver stem cells[J].Nature Commun,2017,8(1):1 175.
[25] ISHIKAWA T,FACTOR V M,MARQUARDT J U,et al.Hepatocyte Growth Factor(HGF)/c-Met Signaling is required for Stem Cell Mediated Liver Regeneration[J].Hepatology,2012,55(4):1 215-1 226.
[26] BYE N,ZIEBA M,WREFORD N G,et al.Resistance of the dentate gyrus to induced apoptosis during ageing is associated with increases in transforming growth factor-b1 messenger RNA[J].Neuroscience,2001,105:853-862.
[27] POWELL R J,SIMONS M,MENDELSOHN F O,et al.Results of a double-blind,placebo-controlled study to assess the safety of intramuscular injection of hepatocyte growth factor plasmid to improve limb perfusion in patients with critical limb ischemia[J].Circulation,2008,118(1):58-65.
[28] KO B,HE T,GADGEEL S,et al.MET/HGF pathway activation as a paradigm of resistance to targeted therapies[J].Ann Transl Med,2017,5(1):4.
[29] WANG J,FU X,ZHANG D,et al.Effects of crenol-anib,a nonselective inhibitor of PDGFR,in a mouse model of transient middle cerebral artery occlusion[J].Neuroscience,2017,364:202-211.
(收稿2017-03-09 修回2018-02-10)
本文编辑:夏保军
本文引用信息:赵晟昊,李彤,王凡.外源性HGF对增龄和动脉硬化大鼠HGF和TGF-β1平衡的影响[J].中国实用神经疾病杂志,2018,21(9):935-941.DOI:10.12083/SYSJ.2018.09.236