目的 探讨多b值扩散加权序列的三指数模型拟合相关参数3D兴趣区直方图分析在胶质瘤术前分级中的价值。方法 分析2016-08—2018-02经病理证实的46例(低级别组17例,高级别组29例)胶质瘤患者的MRI影像资料,分别测量三维ROI直方图分析三指数模型相关参数,对低级别组和高级别组上述参数进行比较。结果 低级别和高级别组Ds-P5、Ds-P10、Ff-mean和Ff-median比较差异均有统计学意义,分别为:Ds-P5(0.76±0.08)×10-3 mm2/s vs (0.73,0.06)×10-3 mm2/s(IQR,P=0.010);Ds-P10(0.84±0.10)×10-3 mm2/s vs (0.80,0.09)×10-3 mm2/s (IQR,P=0.013);Ff-mean 0.20±0.04 vs 0.22±0.04(P=0.033);Ff-median 0.15±0.06 vs 0.20±0.04(P=0.003)。结论 三指数模型3D兴趣区直方图分析相关参数可以很好地进行胶质瘤术前分级。
三指数模型在胶质瘤术前分级中的价值:3D兴趣区直方图分析
李建红1) 杜 勇1) 肖 翔2) 张 静2) 许乙凯2) 王春红1)△
1)信阳市中心医院医学影像科,河南 信阳 464000 2)南方医科大学附属南方医院影像中心,广东 广州 510515
作者简介:李建红,Email:ljh820323@163.com
△通信作者:王春红,Email:wch781216@163.com
【摘要】 目的 探讨多b值扩散加权序列的三指数模型拟合相关参数3D兴趣区直方图分析在胶质瘤术前分级中的价值。方法 分析2016-08—2018-02经病理证实的46例(低级别组17例,高级别组29例)胶质瘤患者的MRI影像资料,分别测量三维ROI直方图分析三指数模型相关参数,对低级别组和高级别组上述参数进行比较。结果 低级别和高级别组Ds-P5、Ds-P10、Ff-mean和Ff-median比较差异均有统计学意义,分别为:Ds-P5(0.76±0.08)×10-3 mm2/s vs (0.73,0.06)×10-3 mm2/s(IQR,P=0.010);Ds-P10(0.84±0.10)×10-3 mm2/s vs (0.80,0.09)×10-3 mm2/s (IQR,P=0.013);Ff-mean 0.20±0.04 vs 0.22±0.04(P=0.033);Ff-median 0.15±0.06 vs 0.20±0.04(P=0.003)。结论 三指数模型3D兴趣区直方图分析相关参数可以很好地进行胶质瘤术前分级。
【关键词】 胶质瘤;扩散加权成像;三指数模型;ROC曲线;直方图
【中图分类号】 R730.264 【文献标识码】 A 【文章编号】 1673-5110(2019)01-0034-06 DOI:10.12083/SYSJ.2019.01.007
The value of tri-exponential model related parameters in preoperative grading of glioma:A three-dimension histogram method exploring
LI Jianhong1),DU Yong1),XIAO Xiang2),ZHANG Jing2),XU Yikai2),WANG Chunhong1)
1)Department of Medical Imaging,Xinyang Central Hospital,Xinyang 464000,China;2)Department of Medical Imaging,Nanfang Hospital,Southern Medical University,Guangzhou 510515,China
【Abstract】 Objective To explore the value of three-dimension histogram method for tri-exponential model related parameters in preoperative grading of glioma.Methods From Aug.2016 to Feb.2018,46 patients (28 men,18 women;10-72 years old;17 low grade gliomas,29 high grade gliomas) received a pathologic diagnosis and MR scan.The three-dimension histogram method of tri-exponential model related parameters based on multi-b value DWI sequence were measured,and then compared the difference between low-and high-grade gliomas.Results Ds-P5,Ds-P10,Ff-mean and Ff-median showed obvious difference between low-and high-grade gliomas,Ds-P5 value were (0.76±0.08)×10-3mm2/s and (0.73,0.06)×10-3mm2/s(IQR,P=0.010),Ds-P10 value were (0.84±0.10)×10-3mm2/s and (0.80,0.09)×10-3mm2/s (IQR,P=0.013),Ff-mean value were 0.20±0.04 and 0.22±0.04 (P=0.033),Ff-median value were 0.15±0.06 and 0.20±0.04(P=0.003),respectively;but other parameters showed no differences.Conclusion Three-dimension histogram method for tri-exponentioal related parameters of Ds value and Ff value might be of value to differentiate low-and high-grade gliomas.
【Key words】 Glioma;Diffusion weighted imaging;Tri-exponential model;Receiver operating characteristic curve;Histogram
脑胶质瘤是是颅内原发肿瘤中发病率最高的肿瘤[1]。世卫组织将脑神经胶质瘤分为低级别(WHOⅠ、Ⅱ)和高级别(WHOⅢ、Ⅳ)胶质瘤[2-4]。对胶质瘤进行术前分级在临床实践中至关重要,对治疗方案的选择和预后判断有重大意义。
常规序列的MRI检查在神经胶质瘤术前分级中有一定价值,主要依据病变周围的水肿及强化程度等特征判断,但有时仅依靠病变强化判定胶质瘤分级可能存在困惑[5]。目前,一些新的技术,如波谱、扩散加权成像和灌注成像成为临床评价脑肿瘤的成像方法[6-9]。多b值扩散加权成像不依赖对比剂,表现出明显的优势,并可以同时反映病变内的扩散和灌注相关信息[10]。多b值序列可以用单指数模型、拉伸指数模型和双指数模型进行拟合。部分研究探讨了这些拟合模型的价值[11-15]。最近,三指数模型被提出[16-17],通过拟合可以计算出慢扩散系数(Ds)、快速扩散系数(Df)、灌注相关扩散系数(Dp)及其对应的分数Fs、Ff和Fp。有研究探索了该模型在脑内应用的可行性,认为新的拟合模型很有价值,其可以使用非侵入方式收集大脑灌注和扩散信息[18]。本研究尝试使用3D兴趣区直方图分析法探讨三指数模型相关参数在鉴别低级别与高级别胶质瘤中的价值,目前直方图分析方法还未在三指数模型中应用,有部分文献研究了其他参数的直方图应用[7,19-20]。
1 资料与方法
1.1 一般资料 收集2016-08—2018-02信阳市中心医院有病理结果的胶质瘤患者46例,男28例,女18例,其中低级别组17例(46.9%),高级别组29例(53.1%)。
入组标准:(1)病理结果证实为胶质瘤;(2)初次发病,行MRI 检查前未经过手术、放疗、化疗及抗血管生成等治疗。排除标准:(1)病理结果不是胶质瘤或未能得到病理结果;(2)资料不全或图像质量不能满足诊断和研究要求;(3)手术与MRI检查间距时间>1个月。
1.2 磁共振检查与图像分析
1.2.1 磁共振检查:所有患者磁共振检查全部在信阳市中心医院医学影像科3.0T磁共振扫描系统上完成(Achieva;Philips Healthcare,Netherlands),使用8通道正交头部线圈。扫描方案包括轴位T1WI、轴位T2WI、轴位FLAIR、矢状位T2WI和轴位多b值DWI序列(14b值),所有轴位图像采用统一FOV(24 cm)、层厚(6 mm)和层数(20层);DWI序列(14b值):TR=6 600 ms,TE=Shortest,flip angle=90°,matrix=128×128,NEX=1,Directions=3,b Value=0、10、20、40、60、100、140、160、200、300、500、1 000、1 500、2 000 s/mm2。
1.2.2 多b值扩散加权序列数据处理:多b值扩散加权序列数据处理在第三方软件包上进行(基于Matlab自主开发软件,郭义昊,陈茂东,南方医科大学生物医学工程学院)。
三指数模型拟合参考文献[18]分两步进行。首先,根据公式(1)拟合,其中S代表给定b值的信号强度,Sint代表b值为0时的的信号强度,Ds为慢扩散相关系数,此次拟合使用b值>1 000 s/mm2数据。第二步拟合,其中Df值根据文献在3.0T场强下固定为3.0×10-3mm2/s,然后根据公式(2)拟合,可以得出其他参数,Dp代表灌注相关系数,Fs、Ff和Fp分别代表各扩散系数的相应分数。
S=Sint·exp(-bDs) (1)
S=S0· (2)
1.2.3 ROI的定义:选择包括肿瘤的所有层面计算出各参数图(兴趣区除去肿瘤坏死、出血、钙化及可见的大血管等区域),最后将所勾画ROI拷贝至各参数图上,计算每种参数图上ROI区域直方图相关参数,包括第5、10、90、95百分位数和均数、中位数。
1.3 统计学分析 使用SPSS 20.0软件进行数据分析,低级别组与高级别组比较,采用独立样本t检验(变量符合正态分布)或Mann-Whitney U检验(变量不符合正态分布),性别比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 低级别组年龄(38.94±14.64)岁,中位年龄40岁(14~63岁);高级别组年龄(51.45±13.88)岁,中位年龄53岁(10~72岁),高级别组年龄略大(t=-2.891,P=0.006)。性别分布比较,低级别组男9例,女8例;高级别组男19例,女10例,2组间性别分布相近,差异无统计学意义(χ2=0.712,P=0.399)。患者临床症状无相对特异性,主要以头痛、癫痫、记忆力低下、反应迟钝和肢体感觉、运动障碍为主。
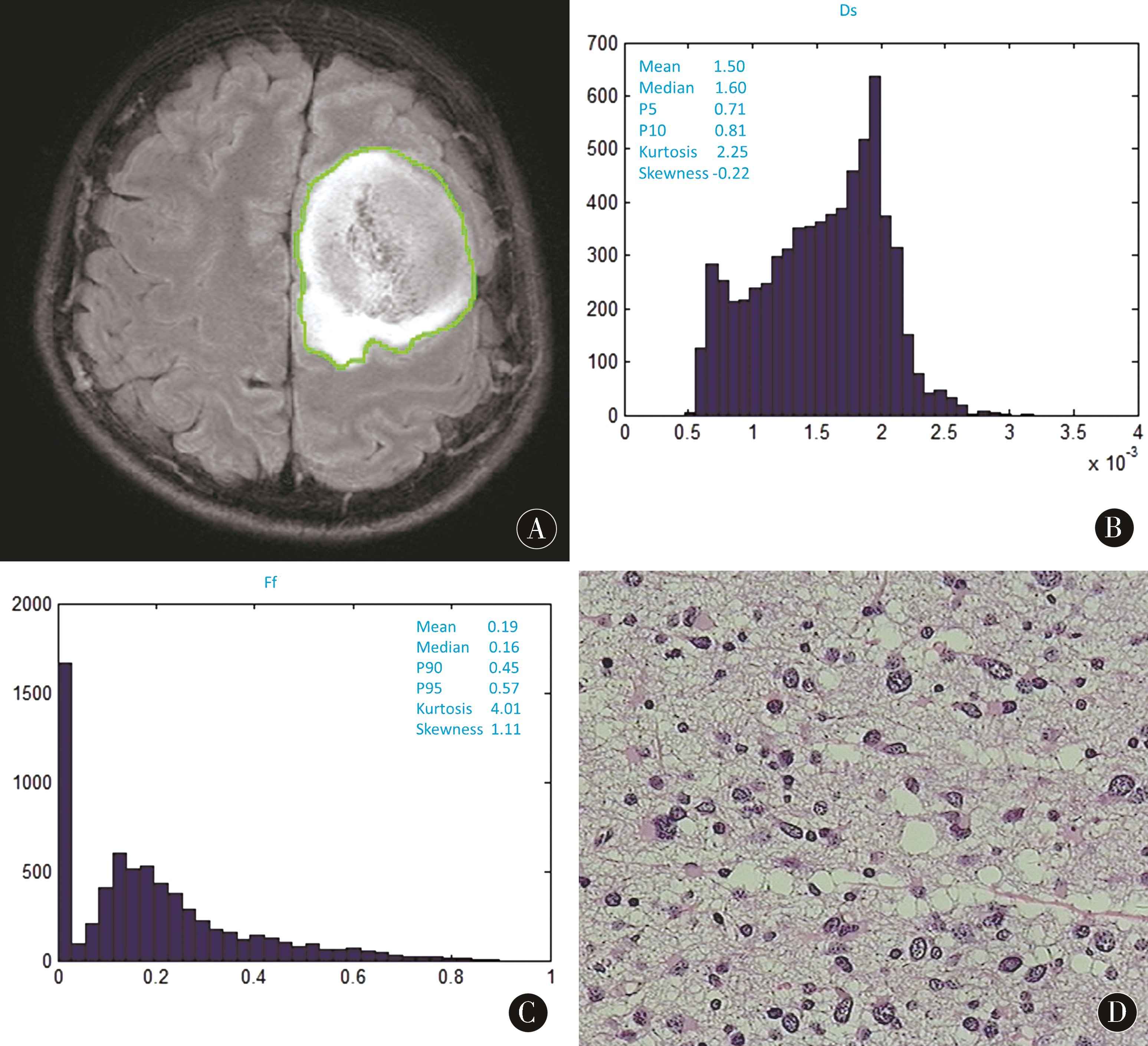
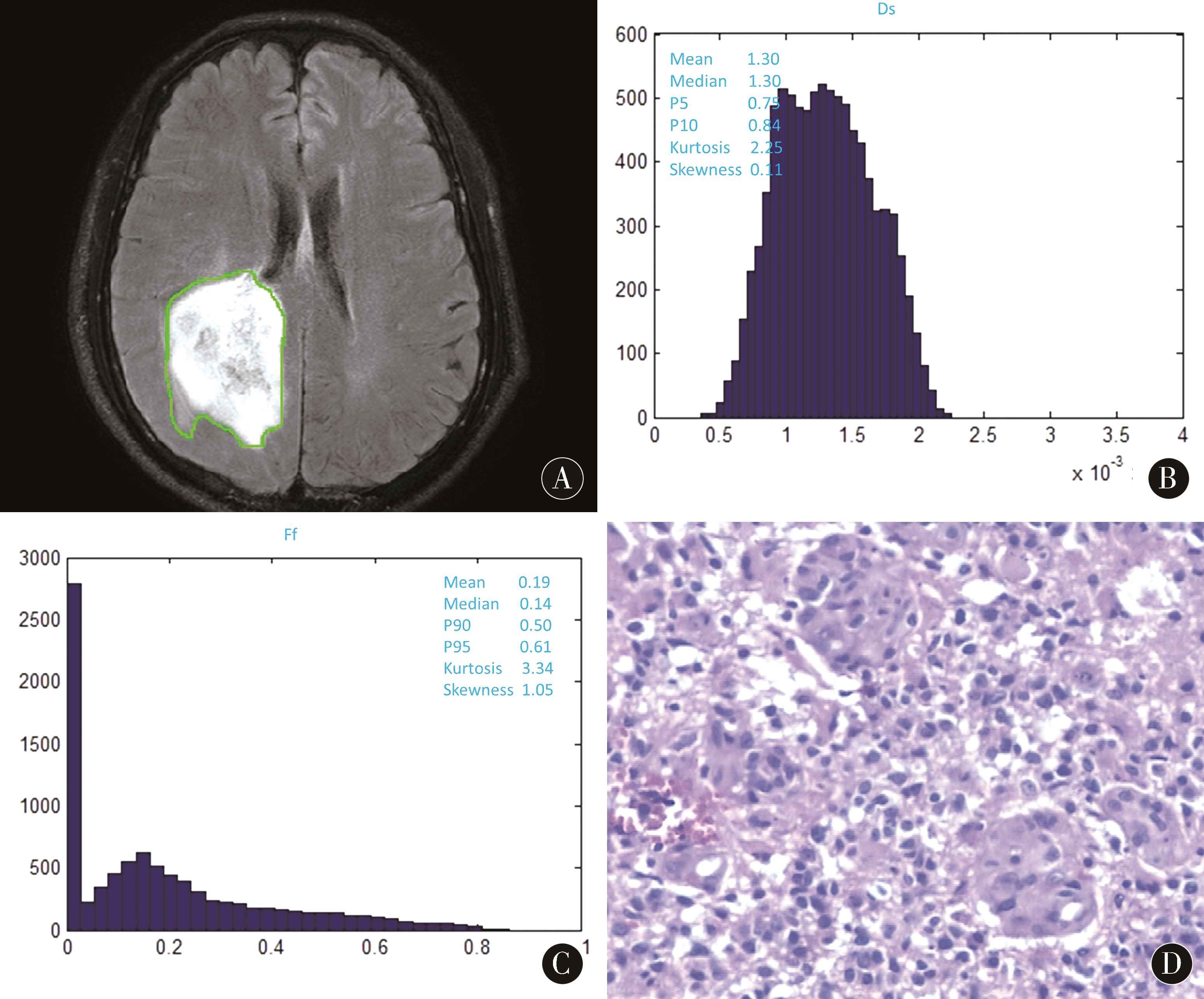
2.2 病理结果 低级别组17例,均为WHOⅡ级,高级别组29例,其中WHOⅢ级11例,Ⅳ级18例。组织学类型结果如下:低级别组包括星形细胞瘤12例(图1D),少突胶质星形细胞瘤3例,纤维型星形细胞瘤2例;高级别组包括多形性胶质母细胞瘤17例,间变星形细胞瘤4例,间变少突胶质星形细胞瘤4例,间变少突胶质细胞瘤3例(图2D),小细胞胶质母细胞瘤1例。
2.3 2组三指数模型拟合相关参数比较 传统序列有时不能很好地鉴别低级别和高级别胶质瘤(图1A、2A)。低级别组与高级别组比较,Ds-P5、Ds-P10、Ff-mean和Ff-median差异均有统计学意义(P<0.05)。Ds-P5和Ds-P10分别为(0.76±0.08)×10-3mm2/s vs(0.73,0.06)×10-3mm2/s(IQR,P=0.010)、(0.84±0.10)×10-3mm2/s vs(0.80,0.09)×10-3mm2/s (IQR,P=0.013),低级别组高于高级别组(图1B、2B、表1);Ff-mean和Ff-median分别为0.20±0.04 vs 0.22±0.04(P=0.033)、0.15±0.06 vs 0.20±0.04(P=0.003),低级别组低于高级别组(图1C、2C、表1)。2组其他相关参数差异无统计学意义(P>0.05)。
图1 患者男,26岁,左侧额叶肿块影,FLAIR序病灶瘤周水肿较轻,显示3D ROI勾勒方法(A,单层示意图);Ds-p5值为0.71×10-3mm2/s,Ds-p10值为0.81×10-3mm2/s(B);Ff-mean值为0.19,Ff-median值为0.16(C);病理结果为星形细胞瘤(D,WHOⅡ级)
Figure 1 Male,26 years old,with amass in the left frontal lobe,with a relatively light edema on FLAIR image,which showed the ROI delineation method (A,single slice);Ds-p5 was 0.71×10-3mm2/s,and Ds-p10 was 0.81 × 10-3mm2/s (B);The Ff-mean value was 0.19,and the Ff-median value was 0.16(C);The pathological Results were astrocytoma (D,WHOⅡ)
表1 2组三指数模型相关参数比较
Table 1 Comparison of tri-exponential model related parameters between two groups
| 参数 |
低级别组 |
高级别组 |
P值 |
| Ds-P5 |
0.76±0.08 |
0.73,0.06 |
0.010& |
| Ds-P10 |
0.84±0.10 |
0.80,0.09 |
0.013& |
| Ff-mean |
0.20±0.04 |
0.22±0.04 |
0.033# |
| Ff-median |
0.15±0.06 |
0.20±0.04 |
0.003# |
注:#t检验;&Mann-Whitney U检验
2.4 诊断指标效能评价区分 低级别组和高级别组胶质瘤,当Ds-P5的截断值取0.77×10-3mm2/s时,其敏感性和特异性分别为52.9%和93.1%;当Ds-P10的截断值取0.86×10-3mm2/s时,其敏感性和特异性分别为47.1%和96.6%;Ff-mean的截断值取0.23时,其敏感性和特异性分别为41.4%和89.2%;Ff-median的截断值取0.17时,其敏感性和特异性分别为75.9%和64.7%(表2)。
Ds-P5的ROC曲线下面积(AUC)为0.728(P=0.010),Ds-P10的AUC为0.722(P=0.013),Ff-mean的AUC为0.665(P=0.064),Ff-median的AUC为0.721(P=0.013)。这些参数能为鉴别低级别与高级别胶质瘤提供有价值信息(表2)。
图2 患者男,55岁,右侧顶叶肿块影,FLAIR序病灶瘤周水肿不明显,显示3D ROI勾勒方法(A,单层示意图);Ds-p5值为0.75×10-3mm2/s,Ds-p10值为0.84×10-3mm2/s(B);Ff-mean值为0.19,Ff-median值为0.14(C);病理结果为间变少突胶质细胞瘤(D,WHOⅢ级)
Figure 2 Male,55 years old,with amass in the right parietal lobe,with a relatively light edema on FLAIR image,which showed the ROI delineation method (A,single slice);Ds-p5 was 0.75×10-3mm2/s,and Ds-p10 was 0.84×10-3mm2/s (B).The Ff-mean value was 0.19,and the Ff-median value was 0.14(C).The pathological Results were anaplastic oligodendrocytoma (D,WHO Ⅲ)
表2 Ds值和Ff值的ROC曲线比较
Table 2 ROC curve comparison of Ds and Ff
| 参数 |
AUC |
P值 |
截断值 |
敏感性/% |
特异性/% |
| Ds-P5 |
0.728 |
0.01 |
0.77 |
52.9 |
93.1 |
| Ds-P10 |
0.722 |
0.013 |
0.86 |
47.1 |
96.6 |
| Ff-mean |
0.665 |
0.064 |
0.23 |
41.4 |
89.2 |
| Ff-median |
0.721 |
0.013 |
0.17 |
75.9 |
64.7 |
3 讨论
胶质瘤术前分级对治疗方法的选择和预后评价很重要。磁共振传统序列在术前分级中有时会有局限,因不同级别胶质瘤的影像表现会有重叠。部分研究已表明,血管渗透性的信息有助于胶质瘤分级[7]。灌注成像技术由于能够评价肿瘤内毛细血管通透性,成为一种最有效的胶质瘤分级方法[11]。
随着多b值扩散加权成像不同拟合模型的提出[9-10],可同时评价肿瘤组织中的扩散和灌注相关信息,为胶质瘤分级提供了新的模式,而三指数模型被认为是适合描述组织的扩散和灌注信息的拟合模型。
细胞密度和有丝分裂活动是神经胶质瘤组织病理学重要的一个分级标准,有文献认为DWI序列相关参数ADC值和D值与细胞密度相关性较高,对分级有较高价值[14,21]。本研究显示,Ds-P5和Ds-P10在低级别和高级别组间有明显差异,能显示不同级别肿瘤内细胞密度及水分子扩散的差异,对胶质瘤分级有潜在的价值。
肿瘤新生血管形成是恶性神经胶质瘤的特点,因此,可通过定量评价肿瘤内的微血管为分级提供依据[22-23]。本研究显示,Ff-mean和Ff-median在低级别和高级别组间有明显差异,与以往有关灌注相关参数的研究结果一致。
由于参数拟合的鲁棒性较差,本次研究未评估Dp值,与以往研究结果有出入[16-17]。部分研究中给出的Dp值结果的标准差很大[21],可能由于Dp值与双指数模型中的D*值一样信噪比较低所致[11]。
本研究仍存在局限性。首先,三指数模型相关参数值会受到b值分布的影响[11,16,21,24],最优b值方案,仍需进一步探讨。更高的b值能更好地消除灌注相关的扩散,然后得到一个更接近实际的扩散系数值和灌注相关扩散系数值,本研究使用的b值最高为2 000 s/mm2,这比其他作者使用的b值要小[16,18],可能影响相关参数的准确性。其次,本研究中ROI的定义方法使用的是包括全瘤的异常信号区域,虽可见的坏死区、出血、大血管可有排除,但部分较小的坏死、出血等区域可能会影响到结果的准确性。最后,本研究未探讨三指数模型直方图分析相关参数与肿瘤的分子标志物的关联,有文献证实分子标志物与肿瘤的诊断和预后判断有明显关系[25-29],希望在下一步的研究中探讨相关问题。
三指数模型作为一种新的拟合模型,可在一个多b值的扩散加权序中分离出扩散相关信息和灌注相关信息,通过3D直方图分析能为胶质瘤的术前分级提供有价值信息。
4 参考文献
[1] HEILAND D H,SIMON-GABRIEL C P,DEMERATH T,et al.Integrative Diffusion-Weighted Imaging and Radiogenomic Network Analysis of Glioblastoma multiforme[J].Sci Rep,2017,7:43 523.
[2] LOUIS D N,PERRY A,REIFENBERGER G,et al.The 2016 World Health Organization Classification of Tumors of the Central Nervous System:a summary[J].Acta Neuropathologica,2016,131(6):803-820.
[3] HUANG J,LUO J,PENG J,et al.Cerebral schistosomiasis:diffusion-weighted imaging helps to differentiate from brain glioma and metastasis[J].Acta Radiol,2017,58(11):1 371-1 377.
[4] 张雪峰,高洁,王亮,等.MRS及DWI在脑胶质瘤中的应用价值[J].中国实用神经疾病杂志,2013,16(24):6-8.
[5] LEV M H,OZSUNAR Y,HENSON J W,et al.Glial Tumor Grading and Outcome Prediction Using Dynamic Spin-Echo MR Susceptibility Mapping Compared with Conventional Contrast-Enhanced MR:Confounding Effect of Elevated rCBV of Oligodendroglimoas[J].AJNR Am J Neuroradiol,2004,25(2):214-221.
[6] KONG L,CHEN H,YANG Y,et al.A meta-analysis of arterial spin labelling perfusion values for the prediction of glioma grade[J].Clin Radiol,2017,72(3):255-261.
[7] SANTAROSA C,CASTELLANO A,CONTE G M,et al.Dynamic contrast-enhanced and dynamic susceptibi-lity contrast perfusion MR imaging for glioma grading:Preliminary comparison of vessel compartment and permeability parameters using hotspot and histogram analysis[J].Eur J Radiol,2016,85(6):1 147-1 156.
[8] YANG D,KOROGI Y,SUGAHARA T,et al.Cerebral gliomas:prospective comparison of multivoxel 2D chemical-shift imaging proton MR spectroscopy,echoplanar perfusion and diffusion-weighted MRI[J].Neuroradiology,2002,44(8):656-666.
[9] BISDAS S,BRAUN C,SKARDELLY M,et al.Correlative assessment of tumor microcirculation using contrast-enhanced perfusion MRI and intravoxel incoherent motion diffusion-weighted MRI:is there a link between them?[J].NMR Biomed,2014,27(10):1 184-1 191.
[10] LIN Y,LI J,ZHANG Z,et al.Comparison of Intravoxel Incoherent Motion Diffusion-Weighted MR Imaging and Arterial Spin Labeling MR Imaging in Gliomas[J].BioMed Res Int,2015,2015:234 245.
[11] WU W,CHEN Y,TSENG H,et al.Caveat of measur-ing perfusion indexes using intravoxel incoherent motion magnetic resonance imaging in the human brain[J].Eur Radiol,2015,25(8):2 485-2 492.
[12] TOGAO O,HIWATASHI A,YAMASHITA K,et al.Differentiation of high-grade and low-grade diffuse gliomas by intravoxel incoherent motion MR imaging[J].Neuro-Oncology,2015,18(1):132-141.
[13] WANG C,REN D,GUO Y,et al.Distribution of intravoxel incoherent motion MRI-related parameters in the brain:evidence of interhemispheric asymmetry[J].Clin Radiol,2017,72(1):91-94.
[14] HU Y,YAN L,WU L,et al.Intravoxel incoherent motion diffusion-weighted MR imaging of gliomas:efficacy in preoperative grading[J].Sci Rep,2015,4:7 208.
[15] FEDERAU C,MEULI R,O'BRIEN K,et al.Perfusion Measurement in Brain Gliomas with Intravoxel Incoherent Motion MRI[J].Am J Neuroradiol,2014,35(2):256-262.
[16] NICOLAS R,SIBON I,HIBA B.Accuracies and Contrasts of Models of the Diffusion-Weighted-Dependent Attenuation of the MRI Signal at Intermediate b-values[J].Magn Reson Insights,2015,2015(8):11-21.
[17] UEDA Y,TAKAHASHI S,OHNO N,et al.Triexponential function analysis of diffusion-weighted MRI for diagnosing prostate cancer[J].J Magn Reson Imaging,2016,43(1):138-148.
[18] OHNO N,MIYATI T,KOBAYASHI S,et al.Modifi-ed triexponential analysis of intravoxel incoherent motion for brain perfusion and diffusion[J].J Magn Reson Imaging,2016,43(4):818-823.
[19] FALK A,FAHLSTRÖM M,ROSTRUP E,et al.Discrimination between glioma grades Ⅱand Ⅲ in suspected low-grade gliomas using dynamic contrast-enhanced and dynamic susceptibility contrast perfusion MR imaging:a histogram analysis approach[J].Neuroradiology,2014,56(12):1 031-1 038.
[20] LEE J,CHOI S H,KIM J,et al.Glioma grading using apparent diffusion coefficient map:application of histogram analysis based on automatic segmentation[J].NMR Biomed,2014,27(9):1 046-1 052.
[21] HU Y C,YAN L F,SUN Q,et al.Comparison between ultra-high and conventional mono b-value DWI for preoperative glioma grading[J].Oncotarget,2017,8(23):37 884-37 895.
[22] JAIN R,GRIFFITH B,ALOTAIBI F,et al.Glioma Angiogenesis and Perfusion Imaging:Understanding the Relationship between Tumor Blood Volume and Leakiness with Increasing Glioma Grade[J].Am J Neuroradiol,2015,36(11):2 030-2 035.
[23] BENNETT I E,GUO H,KOUNTOURI N,et al.Preoperative biomarkers of tumour vascularity are elevated in patients with glioblastoma multiforme[J].J Clin Neurosci,2015,22(11):1 802-1 808.
[24] LEMKE A,STIELTJES B,SCHAD L R,et al.Toward an optimal distribution of b values for intravoxel incoherent motion imaging[J].Magn Reson Imaging,2011,29(6):766-776.
[25] CARCELLER F,JEROME N P,MIYAZAKI K,et al.Feasibility and applicability of diffusion-weighted and dynamic contrast-enhanced magnetic resonance imaging in routine assessments of children with high-grade gliomas[J].Pediatr Blood Cancer,2017,64(2):279-283.
[26] TOGAO O,HIWATASHI A,YAMASHITA K,et al.Grading diffuse gliomas without intense contrast enhancement by amide proton transfer MR imaging:comparisons with diffusion-and perfusion-weighted imaging[J].Eur Radiol,2017,27(2):578-588.
[27] BAI Y,LIN Y,TIAN J,et al.Grading of Gliomas by Using Monoexponential,Biexponential,and Stretched Exponential Diffusion-weighted MR Imaging and Diffusion Kurtosis MR Imaging[J].Radiology,2016,278(2):496-504.
[28] AREVALO-PEREZ J,PECK K K,YOUNG R J,et al.Dynamic Contrast-Enhanced Perfusion MRI and Diffusion-Weighted Imaging in Grading of Gliomas[J].J Neuroimaging,2015,25(5):792-798.
[29] CHEN S D,HOU P F,LOU L,et al.The correlation between MR diffusion-weighted imaging and pathological grades onglioma[J].Eur Rev Med Pharmacol Sci,2014,18(13):1 904-1 909.
(收稿2018-05-14)
本文引用信息:李建红,杜勇,肖翔,张静,许乙凯,王春红.三指数模型在胶质瘤术前分级中的价值:3D兴趣区直方图分析[J].中国实用神经疾病杂志,2019,22(1):34-39.DOI:10.12083/SYSJ.2019.01.007
Reference information:LI Jianhong,DU Yong,XIAO Xiang,ZHANG Jing,XU Yikai,WANG Chunhong.The value of tri-exponential model related parameters in preoperative grading of glioma:A three-dimension histogram method exploring[J].Chinese Journal of Practical Nervous Diseases,2019,22(1):34-39.DOI:10.12083/SYSJ.2019.01.007