目的 探讨血清miR-155及其靶基因缺氧诱导因子1α(hypoxiainducible factor 1α,HIF1A)与急性脑梗死(acute cerebral infarction,ACI)的相关性,探寻与ACI诊断及治疗有关的潜在血清生物标志物。方法 实时荧光定量聚合酶链反应(real time-PCR)法检测ACI患者和健康对照组血清miR-23b、miR-106b、miR-130a、miR-155和miR-425的表达水平,使用miRBase和TargetScan数据库推测靶基因,并应用双荧光素酶报告和蛋白质印迹分析的办法验证,应用多变量Logistic回归分析等进行分析。结果 与健康对照组相比,ACI患者血清miR-155水平显著上调(P<0.05);经验证HIF1A是miR-155的靶基因;ACI患者血清HIF1A mRNA的表达水平显著下调(P<0.05),与miR-155的表达呈显著负相关(P<0.05);单独或联合存在的miR-155高表达和HIF1A mRNA低表达均与ACI患者的高总胆固醇(P<0.05)、高LDL(P<0.05)和低HDL(P<0.05)有显著相关性;此外,高表达的miR-155(P<0.05)、低表达的HIF1A mRNA(P<0.05),或者高miR-155和低HIF1A mRNA的联合表达都可能是检测ACI的指标。结论 血清miR-155上调及其靶基因HIF1A的下调与ACI具有相关性,可能对开发针对ACI的miRNA定向诊断有参考意义。
血清miR-155及缺氧诱导因子1α的表达对急性脑梗死的诊断价值
王兴萍 王 鹏 程 度 何远宏 王建平
郑州大学第五附属医院神经内科,河南 郑州 450052
作者简介:王兴萍,Email:wxppp_2004@126.com
【摘要】 目的 探讨血清miR-155及其靶基因缺氧诱导因子1α(hypoxiainducible factor 1α,HIF1A)与急性脑梗死(acute cerebral infarction,ACI)的相关性,探寻与ACI诊断及治疗有关的潜在血清生物标志物。方法 实时荧光定量聚合酶链反应(real time-PCR)法检测ACI患者和健康对照组血清miR-23b、miR-106b、miR-130a、miR-155和miR-425的表达水平,使用miRBase和TargetScan数据库推测靶基因,并应用双荧光素酶报告和蛋白质印迹分析的办法验证,应用多变量Logistic回归分析等进行分析。结果 与健康对照组相比,ACI患者血清miR-155水平显著上调(P<0.05);经验证HIF1A是miR-155的靶基因;ACI患者血清HIF1A mRNA的表达水平显著下调(P<0.05),与miR-155的表达呈显著负相关(P<0.05);单独或联合存在的miR-155高表达和HIF1A mRNA低表达均与ACI患者的高总胆固醇(P<0.05)、高LDL(P<0.05)和低HDL(P<0.05)有显著相关性;此外,高表达的miR-155(P<0.05)、低表达的HIF1A mRNA(P<0.05),或者高miR-155和低HIF1A mRNA的联合表达都可能是检测ACI的指标。结论 血清miR-155上调及其靶基因HIF1A的下调与ACI具有相关性,可能对开发针对ACI的miRNA定向诊断有参考意义。
【关键词】 急性脑梗死;缺血性脑卒中;血清miRNA;微小RNA;miR-155;缺氧诱导因子1α;基因诊断
【中图分类号】 R743.33 【文献标识码】 A 【文章编号】 1673-5110(2019)02-0124-08 DOI:10.12083/SYSJ.2019.02.025
Diagnostic value of serum miR-155 and hypoxia-inducible factor 1α in acute cerebral infarction
WANG Xingping,WANG Peng,CHENG Du,HE Yuanhong,WANG Jianping
Department of Neurology,the Fifth Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China
【Abstract】 Objective To investigate the relationship between serum miR-155 and its target hypoxia inducible factor 1α (HIF1A) and acute cerebral infarction (ACI),and to explore potential serum biomarkers related to ACI.Methods Real-time fluorescence quantitative polymerase chain reaction (PCR) was used to detect the expression levels of serum miR-23b,miR-106b,miR-130a,miR-155 and miR-425 in ACI patients and healthy controls.The target gene was postulated by using miRBase and TargetScan database and verified by dual luciferase reporter and Western blot analysis,and analyzed by multivariate Logistic regression analysis.Results Compared with healthy controls,serum miR-155 levels were significantly up-regulated in ACI patients (P<0.05).HIF1A was the target gene of miR-155.The expression level of serum HIF1A mRNA in ACI patients was significantly down-regulated (P<0.05).There was a significant negative correlation with the expression of miR-155 (P<0.05).High expression of miR-155 and low expression of HIF1A mRNA alone or in combination with high cholesterol (P<0.05) and high LDL in ACI patients (P<0.05) and low HDL (P<0.05);in addition,high expression of miR-155 (P<0.05),low expression of HIF1A mRNA (P<0.05),or high miR-155 and low HIF1A mRNA Combined expression may be an indicator for detecting the presence of ACI.Conclusion Up-regulation of serum miR-155 and down-regulation of its target gene HIF1A are associated with ACI,which may be useful for the development of targeted miRNA diagnosis for ACI.
【Key words】 Acute cerebral infarction;Ischemic stroke;Serum miRNA;MicroRNA;miR-155;Hypoxia-inducible factor 1α;Gene diagnosis
缺血性脑卒中是全球导致死亡和严重长期残疾的第二大主要原因[1-2]。急性脑梗死(acute cerebral infarction,ACI)是脑卒中的主要类型,ACI的常规诊断流程包括病史采集、神经影像学和临床检查,耗时较多[3]。尽管计算机断层扫描(CT)和磁共振成像(MRI)在过去几十年中加速了ACI的诊断过程,但在ACI的管理中远未达到快速诊断的要求[1,4]。 ACI唯一有效的治疗方法是血管内溶栓,但由于时间窗较窄,只有不到3%的ACI患者能够得到及时诊断最终进行溶栓治疗。因此,目前急需开发具有良好特异性和灵敏性诊断生物标志物。微小RNA(miRNA)是长度为18~24个核苷酸的非编码RNA分子,可与其靶基因mRNA 3'未翻译区(UTR)部分或完全结合,导致转录物的降解,干扰翻译功能[5]。miRNA可参与各种细胞生理过程,包括细胞发育、分化、生长、增殖和凋亡[6]。miRNA在许多人类疾病中异常表达,如癌症、炎症、高血压、心肌梗死等[6-9],如miR-155可作为结直肠癌[10]和血液系统恶性肿瘤[11]的良好血清诊断和预后生物标志物,上调潜在的预后生物标志物miR-155可增强口腔鳞状细胞癌患者的细胞增殖[12]。研究表明,ACI患者和ACI动物模型中的血清miRNA表达谱发生了显著改变[13-15],ACI患者血清中存在异常表达的miRNA,包括miR-23b、miR-106b、miR-130a、miR-155和miR-425[16-17],这些miRNA可能成为ACI诊断、治疗和判断预后的潜在生物标志物。本研究旨在验证这些miRNA在ACI患者血清中的表达,并评估这些miRNA作为ACI血清生物标志物的效用。
1 资料和方法
1.1 一般资料 收集2009-01—2014-01郑州大学第五附属医院的100例ACI患者和100名健康人的血清标本。ACI的诊断需要两位神经内科医生达成共识,并通过颅脑CT或MRI证实,排除应用免疫抑制剂治疗、静脉溶栓治疗、感染及淋巴瘤患者。健康对照者排除中风、外周血管疾病或心肌梗死史。
1.2 方法
1.2.1 生化检验:治疗前收集外周血5 mL,室温3 000 g离心10 min,留取上层血清。体重指数(BMI)定义为体质量除以身高的平方(kg/m2)。使用东芝200FR新化学分析仪检测血清甘油三酯、总胆固醇、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、载脂蛋白A1(ApoA1)和载脂蛋白B(ApoB)。
1.2.2 RNA提取和实时荧光定量聚合酶链反应(qPCR):使用Qiagen血液miRNA试剂盒提取总RNA。检测OD值260/280比率1.8~2.1,采用液氮冷冻保存,并用于之后进一步的实验。利用miScript II RT试剂盒将RNA逆转录为cDNA。之后将cDNA模板稀释10倍,使用miScript SYBR®Green PCR试剂盒在Roche Light-Cycler 480 PCR仪上进行。反应条件如下:95 ℃10 min;95 ℃持续10 s和60 ℃持续30 s,45个循环。各基因的引物序列如表1所示。采用小核U6 snRNA(U6)和甘油-醛-3-磷酸脱氢酶(GAPDH)作为内部对照。通过2-ΔΔCT方法对每个基因的相对表达水平进行量化[18]。
1.2.3 生物信息学分析:利用miRBase(http://www.targetscan.org/)和目标扫描(http://www.targetscan.org/)算法对miR-155的靶基因进行预测。
1.2.4 细胞培养和转染:HEK-293T细胞获自美国典型培养物保藏中心(ATCC,Rockville,Maryland,USA),miR-155模拟和模拟对照购自苏州吉玛基因股份有限公司(中国上海)。将约6×106 HEK-293T细胞接种在6孔板中,使用Lipofectamine 2000转染miR-155模拟物或模拟对照。
1.2.5 蛋白质印迹分析(Western blot):用RIPA裂解缓冲液从HEK-293T细胞中提取总蛋白质。测定样本蛋白浓度并调整各样本蛋白浓度一致。将蛋白质进行10% SDS-丙烯酰胺凝胶电泳,转移至聚偏二氟乙烯(PVDF)膜上,孵育一抗4 ℃过夜,洗膜后孵育二抗,化学发光发曝光。抗体来源:小鼠单克隆抗
表1 real time-PCR的引物序列
Table 1 Primer sequences of real time PCR
| 基因 |
正义(5'-3') |
反义(5'-3') |
| miR-23b |
TTAGGGACCGTTACACT |
GTGCAGGGTCCGAGG |
| miR-106b |
ACGTGACAGTCGTGAA |
GTGCAGGGTCCGAGG |
| miR-130a |
CGGGAAAATTGTAACGT |
GTGCAGGGTCCGAGG |
| miR-155 |
GATAGTGCTAATCGTAAT |
GTGCAGGGTCCGAGG |
| miR-425 |
TGCCCTCACTAGCACAGT |
GTGCAGGGTCCGAGG |
| U6 |
GCGCGTCGTGAAGCGTTC |
GTGCAGGGTCCGAGGT |
| HIF1A |
CCCTAACTAGCCGAGGA |
CACAAATCAGCACCAAGC |
| GAPDH |
GCCTCAAGACCTTGGGCT |
CAGTCCCAGCCCAAGGTCT |
HIF1A抗体(ab199004,1∶1 000,Abcam)和小鼠单克隆抗GAPDH抗体(ab8245,1∶5 000,Abcam);二抗:辣根-过氧化物酶结合培养(HRP)次级抗鼠抗体(ab6789,1∶10 000,Abcam)。
1.2.6 质粒构建和双荧光素酶报告基因测定:将含miR-155结合位点(5′-AGCAUUA-3′)的HIF1A的mRNA 3′-UTR亚克隆到空白psiCHECK-2载体质粒(Promega,USA)中,构建广谱型重组质粒载体(psiCHECK2-HIF1A-WT)。通过将miR-155种子区域的互补位点中的推测结合位点改变为5’-GAUGCCG-3’而生成突变型重组质粒载体(psi-CHECK2-HIF1A-MUT)。所有构建的质粒序列均经Sanger/DNA测序验证。
在双荧光素酶报告分析中,将约4×104 HEK-293T细胞接种于24孔板中,通过使用Lipofectamine 2000与psiCHEC-K2-HIF1A-WT或psiCHECK2-HIF1A-MUT报告质粒和miR-155模拟或模拟对照共转染。转染24 h后,使用双荧光素酶报告分析试剂盒在Modulus™单管多模式读数器检测每组的萤光酶和海肾萤光素酶读数。
1.3 统计学分析 使用SPSS 20.0软件分析数据。实验结果表示为均数±标准差(x±s),每个实验重复3次。ACI患者和健康对照之间的临床特征比较采用独立样本t检验。 ANOVA检验用于确定高miR-155组、低HIF1A mRNA组和高miR-155+低HIF1A mRNA组的统计学差异。使用Pearson相关分析分析miR-155和HIF1A mRNA表达之间的相关性。确定ACI与miR-155、HIF1A表达及其他临床表现之间的关系采用多元逻辑回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 样本的临床特征 样本的临床特征分析见表2。ACI患者和健康对照组年龄、性别、吸烟、饮酒、BMI、高血压和糖尿病差异无统计学意义(P>0.05)。与健康对照组相比,ACI患者的总胆固醇和LDL水平较高,而HDL水平较低。甘油三酯、ApoA1和ApoB在ACI患者和健康对照组差异无统计学意义(P>0.05)。
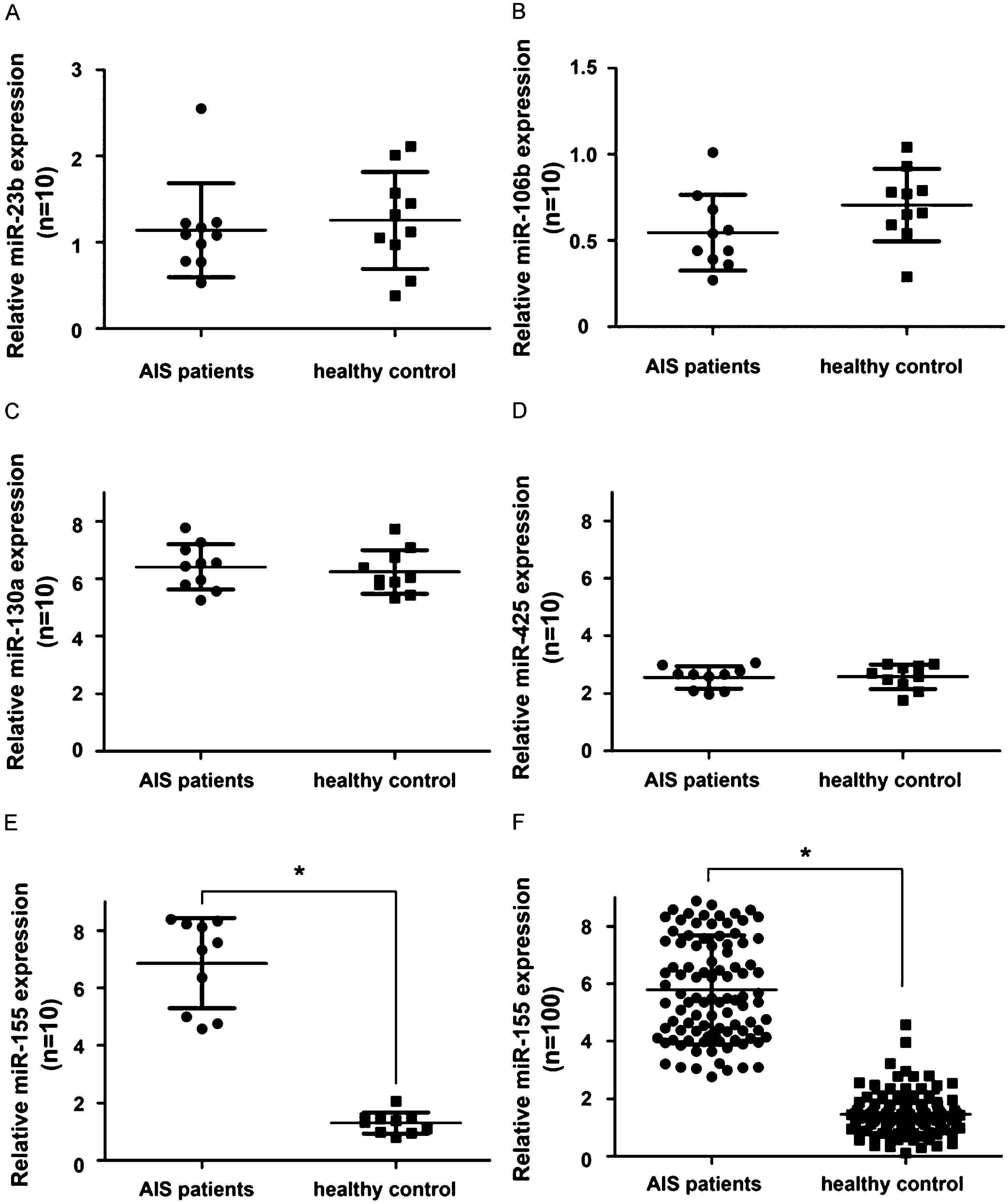
2.2 2组血清miR-155表达情况比较 miR-23b、miR-106b、miR-130a和miR-425的表达差异无统计学意义(P>0.05,图1A~D)。而与健康对照组相比,ACI患者中miR-155的表达显著上调(P<0.05,图1E)。 然后,在较大的研究组中进一步证实了ACI患者血清中miR-155的上调(P<0.05,图1F)。
表2 ACI患者和健康对照的临床特征
Table 2 Clinical features of ACI patients and healthy controls
| 特点 |
ACI患者(n=100) |
健康对照(n=100) |
P值 |
| 性别 |
|
|
0.571 |
| 男[n(%)] |
65(32.5) |
71(35.5) |
|
| 女[n(%)] |
35(17.5) |
29(14.5) |
|
| 年龄/岁 |
55.4±6.7 |
56.3±7.2 |
0.325 |
| BMI指数 |
22.6±5.9 |
21.7±6.4 |
0.236 |
| 抽烟[n(%)] |
42(42) |
49(49) |
0.667 |
| 饮酒[n(%)] |
32(32) |
29(29) |
0.532 |
| 高血压[n(%)] |
57(57) |
47(47) |
0.126 |
| 糖尿病[n(%)] |
23(23) |
18(18) |
0.665 |
| 甘油三酯(mmol/L) |
1.36±0.47 |
1.22±0.36 |
0.479 |
| 总胆固醇(mmol/) |
4.93±1.32 |
3.59±1.13 |
0.023* |
| LDL(mmol/L) |
2.61±0.91 |
1.74±0.87 |
0.016* |
| HDL(mmol/L) |
0.73±0.44 |
1.34±0.24 |
0.009* |
| ApoB(g/L) |
0.75±0.30 |
0.82±0.43 |
0.421 |
| ApoA1(g/L) |
1.36±0.29 |
1.43±0.18 |
0.517 |
注:ACI:急性缺血性中风;BMI:体重指数;HDL:高密度脂蛋白;LDL:低密度脂蛋白;ApoA1:载脂蛋白A1;ApoB:载脂蛋白B;*P<0.05
图1 ACI患者血清中miR-23b、miR-106b、miR-130a、miR-155和miR-425的表达 基于RT-qPCR方法的对ACI患者和健康对照组血清中的表达水平分析:miR-23b(A)、miR-106b(B)、miR-130a(C)、miR-155(D)和miR-425(E);F:与健康对照组相比,ACI患者血清中miR-155的表达显著上调,U6作为内部对照,*P<0.05
Figure 1 Expression of miR-23b,miR-106b,miR-130a,miR-155 and miR-425 in serum of ACI patients.Analysis of expression levels in serum of ACI patients and healthy controls based on RT-qPCR:miR-23b (A),miR-106b (B),miR-130a (C),miR-155 (D) and miR-425 (E);F:expression of miR-155 in serum of patients with ACI compared with healthy controls Significantly up-regulated,U6 as an internal control,*P<0.05
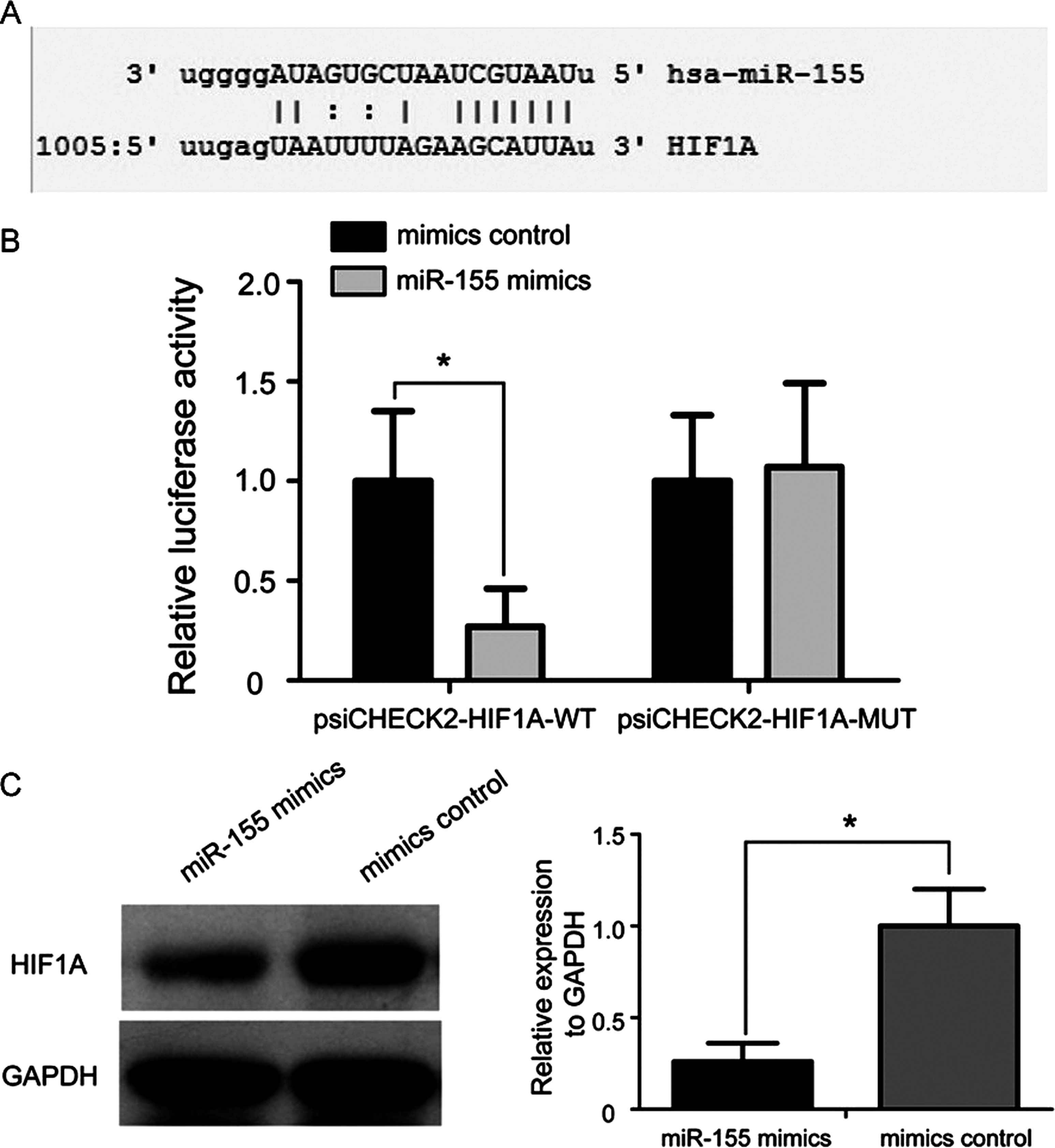
2.3 HIF1A是miR-155的直接靶基因 应用生物信息学预测miR-155的潜在靶基因。MiRanda算法显示miR-155和HIF1A mRNA 3'UTR之间存在潜在的结合位点(图2A)。 为了确认HIF1A是否是miR-155的靶基因,将psiCHECK2-HIF1A-WT或psiCHECK2-HIF1A-MUT报道质粒与miR-155模拟物或模拟对照共转染到HEK-293T细胞中。结果显示,psiCHECK2-HIF1A-WT报告载体中miR-155模拟物抑制了相对荧光素酶活性,而psiCHECK2-HIF1A-MUT报告载体中miR-155模拟物的抑制作用消失(P<0.05,图2B)。另外,如图2C所示,与模拟对照组相比,miR-155模拟物处理的HEK-293T细胞中HIF1A的蛋白质表达水平降低。
图2 HIF1A是miR-155的直接靶基因 A:miR-155和HIF1A mRNA 3'-UTR区域之间可预测的结合位点;B:miR-155模拟物抑制psiCHECK2-HIF1A-WT报告质粒处理的HEK-293T细胞中的相对荧光素酶活性,而psiCHECK2-HIF1A-MUT报告质粒转染的HEK-293T细胞中相对荧光素酶活性未降低;WT:野生型;MUT:突变体;*P<0.05;C:Western印迹分析用于检测转染miR-155模拟物或模拟物对照后HEK-293T细胞中HIF1A的表达水平
Figure 2 HIF1A is a direct target gene of miR-155.A:predictable binding site between miR-155 and HIF1A mRNA 3'-UTR region;B:miR-155 mimic inhibits psiCHECK2-HIF1A-WT reporter plasmid treatment relative luciferase activity in HEK-293T cells,whereas luciferase activity in HEK-293T cells transfected with psiCHECK2-HIF1A-MUT reporter plasmid was not reduced;WT:wild type;MUT:mutant;*P<0.05;C:Western blot analysis was used to detect the expression level of HIF1A expression in HEK-293T cells after transfection of miR-155 mimic or mock control
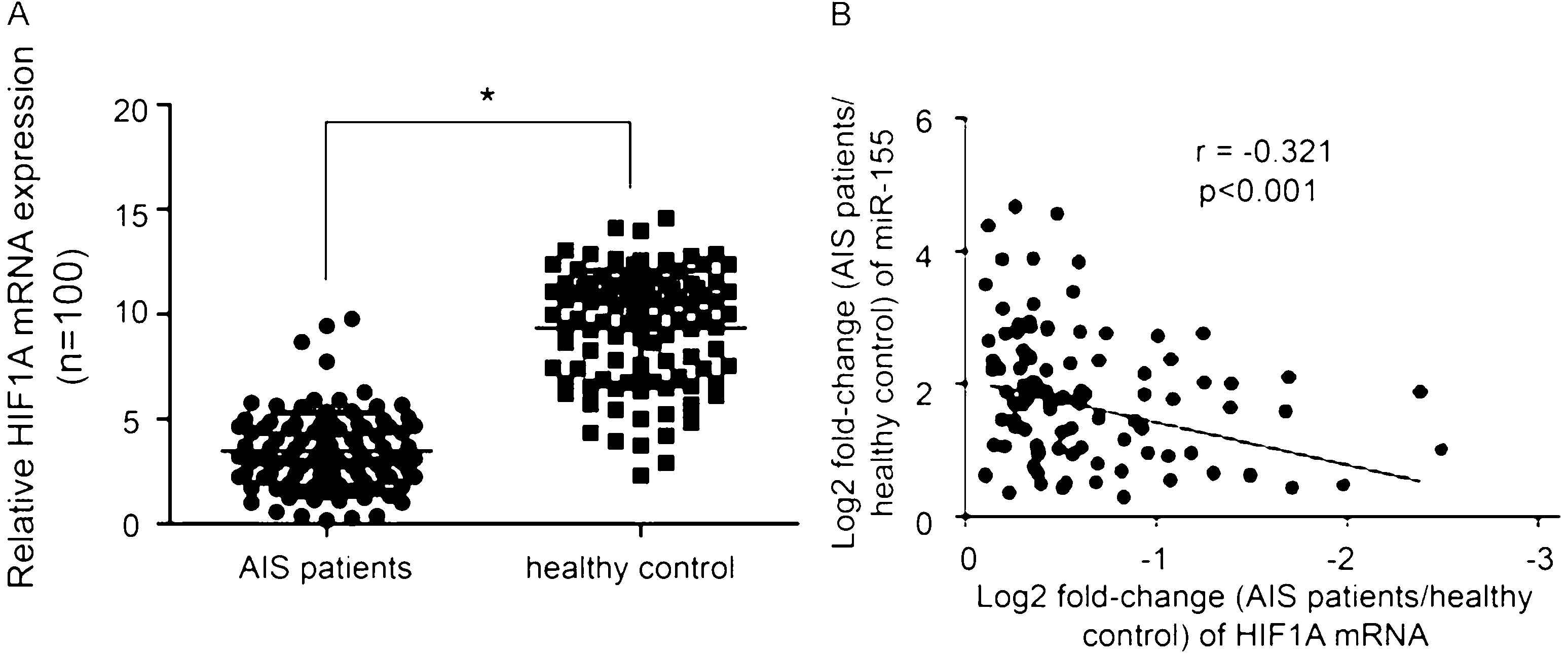
2.4 ACI患者血清HIF1A mRNA表达下调并与miR-155表达呈负相关 与健康对照组相比,ACI患者血清中HIF1A的mRNA表达显著下调(P<0.05,图3A)。相关分析显示,HIF1A mRNA的表达与ACI患者血清中miR-155水平呈显著负相关(P<0.05,图3B)。
2.5 miR-155和HIF1A的异常表达与ACI患者的危险因素显著相关 鉴于ACI患者血清miR-155和HIF1A mRNA的表达水平尚无明确标准,选择miR-155和HIF1A mRNA的中值为阈值。 miR-155高表达组值≥5.84,HIF1A低表达组值≤3.52。如表3所示,无论在单独或组合方式下,miR-155高表达和HIF1A mRNA低表达均与ACI患者的高总胆固醇(P<0.05)、高LDL(P<0.05)和低HDL(P<0.05)呈显著相关。
此外,多变量Logistic回归分析显示,miR-155高表达(P<0.05)、HIF1A mRNA低表达(P<0.05)以及miR-155和HIF1A mRNA的组合表达(P<0.05)都是确定ACI存在的重要且独立的预测因子。见表4。
图3 ACI患者血清中HIF1A下调并与miR-155表达呈负相关 A:RT-qPCR显示,与健康对照组相比,ACI患者血清中HIF1A mRNA表达呈显著下调,GAPDH用作内部对照,*P<0.05;B:HIF1A mRNA的表达与ACI患者血清中miR-155呈显著负相关
Figure 3 Down-regulation of HIF1A in serum of ACI patients is negatively correlated with miR-155 expression.A:RT-qPCR showed that HIF1A mRNA expression was significantly down-regulated in ACI patients compared with healthy controls,and GAPDH was used as an internal control,*P<0.05;B:The expression of HIF1A mRNA was significantly negatively correlated with miR-155 in serum of ACI patients
表3 具有临床特征的ACI患者血清中miR-155和(或)HIF1A mRNA表达的相关性
Table 3 Correlation of miR-155 and/or HIF1A mRNA expression in serum of clinically characterized ACI patients
| 临床特征 |
高miR-155 |
|
低HIF1A mRNA |
|
高miR-155和低HIF1A mRNA |
| 关联系数(r) |
P值 |
|
关联系数(r) |
P值 |
|
关联系数(r) |
P值 |
| 总胆固醇(mg/dL) |
0.271 |
0.002* |
|
0.172 |
0.001* |
|
0.345 |
0.045* |
| LDL(mmol/L) |
0.234 |
0.001* |
|
0.263 |
0.038* |
|
0.409 |
0.007* |
| HDL(mmol/L) |
-0.238 |
0.033* |
|
-0.457 |
0.009* |
|
-0.312 |
0.023* |
注:*P<0.05
表4 对于ACI患者的多变量逻辑回归分析
Table 4 Multivariate Logistic regression analysis for ACI patients
| 变量 |
OR |
95% CI |
P值 |
| 总胆固醇(mg/dL) |
0.895 |
0.212~4.368 |
0.009* |
| LDL(mmol/L) |
0.259 |
0.006~3.295 |
0.001* |
| HDL(mmol/L) |
0.126 |
0.000~2.374 |
0.035* |
| 低HIF1A mRNA |
1.363 |
0.079~5.428 |
0.010* |
| 高miR-155 |
5.352 |
1.674~15.930 |
0.001* |
| 低HIF1A+高miR-155 mRNA |
4.478 |
2.480~10.039 |
0.001* |
注:OR:概率比率;*P<0.05
3 讨论
ACI已经发展成为重大的公共卫生问题,给患者带来了巨大的伤害和沉重的经济负担,确定引起脑损伤的分子机制并探索新的生物标志物是研究热点[19-20]。目前,对于ACI的发病机制及治疗策略,研究人员提出”血管神经网络学说”[21-25]:神经元细胞、脑血管内皮细胞、脑内胶质细胞和脑细胞外基质等形成网状联络结构,共同参与组成血管神经复合体。缺血性脑卒中是发生在神经、实质细胞、血管、基质之间的相互影响的过程。因此,发生脑梗死后不能只关注于保护一种细胞,应关注所有的可能参与发病过程的神经细胞和细胞成分,以及细胞周围环境的变化。已有研究显示,急性脑梗死患者血清miRNAs的表达水平较正常人群显著改变[26-27],提示miRNA可能是诊断、判断预后和急性脑梗死治疗靶点的潜在标志物。
研究表明,ACI患者血清miR-23b、miR-130a、miR-106b、miR-425及miR-155表达异常[16-17]。本研究分析了这些miRNA的表达水平发现,与健康对照组相比,ACI患者血清miR-155表达显著上调。miR-155位于人类染色体21q21.3上,据报道,其可作为结直肠癌[10]和血液系统恶性肿瘤[11]的血清诊断和预后判断的生物标志物。上调潜在的miR-155可增强口腔鳞状细胞癌患者的细胞增殖[12]。研究发现,ACI导致血清miR-155的显著上调,本次研究探讨了这些显著变化的意义。
本研究发现,HIF1A是miR-155的直接靶基因。HIF1A可激活许多基因的转录,是细胞和全身稳定应对缺氧反应的主要调节因子[28],HIF1A的敲除导致脑卒中后神经功能的恶化。HIF1A在低氧分压状态下激活,可后续调节下游相关基因[29],如VEGF、HSP90、Caspase-8、Bcl-2、HSP70、GLUT、iNOS、BNIP3、Caspase-3、EPO等[30]。该改变可促进新生血管形成及红细胞生成,有效提高氧气运输,使细胞更加能够耐受缺氧环境,促进缺氧的细胞尽快恢复功能。本研究中,与健康对照组相比,ACI患者血清HIF1A的mRNA表达显著下调;同时,其表达与ACI患者血清miR-155呈显著负相关,表明miR-155和HIF1A mRNA可能与ACI相关。此外,本研究评估了miR-155和(或)HIF-1A mRNA表达与ACI患者的各种临床特征的关联,显示单独或联合存在的高miR-155表达和低HIF1A mRNA表达均与ACI患者的高总胆固醇、高LDL和低HDL呈显著相关。miR-155和(或)HIF1A mRNA的表达都是确定ACI存在的重要且独立的预测因子。本研究针对HIF1A做出检测,其实用意义在于初步验证我国ACI患者外周循环血HIF1A的表达水平降低,由此类推,如肿瘤、心血管等疾病一样,在ACI病程中HIF1A也同样具有特殊意义和重要作用,且有可能成为一个新的能够预测ACI发病风险的生物标志物。本研究结果的真实性还有待于大样本量实验进一步验证。
4 参考文献
[1] WHITELEY W,CHONG W L,SENGUPTA A,et al.Blood markers for the prognosis of ischemic stroke:a systematic review[J].Stroke,2009,40:e380-389.
[2] ROGER V L,GO A S,LLOYD-JONES D M,et al.American Heart Association Statistics Committee and Stroke Statistics Subcommittee.Executive summary:heart disease and stroke statistics--2012 update:a report from the American Heart Association[J].Circulation,2012,125:188-197.
[3] ZENG Y,LIU J X,YAN Z P,et al.Potential microRNA biomarkers for acute ischemic stroke[J].Int J Mol Med,2015,36:1 639-1 647.
[4] SAENGER A K,CHRISTENSON R H.Stroke biomarkers:progress and challenges for diagnosis,prognosis,differentiation,and treatment[J].Clin Chem,2010,56:21-33.
[5] BARTEL D P.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116:281-297.
[6] BARTEL D P.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136:215-233.
[7] SCHULTE C,ZELLER T.microRNA-based diagnostics and therapy in cardiovascular disease Summing up the facts[J].Cardiovasc Diagn Ther,2015,5:17-36.
[8] MEDINA P P,SLACK F J.microRNAs and cancer:an overview[J].Cell Cycle,2008,7:2 485-2 492.
[9] HOSIN A A,PRASAD A,VIIRI L E,et al.MicroRNAs in atherosclerosis[J].J Vasc Res,2014,51:338-349.
[10] LV Z C,FAN Y S,CHEN H B,et al.Investigation of microRNA-155 as a serum diagnostic and prognostic biomarker for colorectal cancer[J].Tumour Biol,2015,36:1 619-1 625.
[11] JURKOVICOVA D,MAGYERKOVA M,KULCSAR L,et al.miR-155 as a diagnostic and prognostic marker in hematological and solid malignancies[J].Neoplasma,2014,61:241-251.
[12] NI Y H,HUANG X F,WANG Z Y,et al.Upregulation of a potential prognostic biomarker,miR-155,enhances cell proliferation in patients with oral squamous cell carcinoma[J].Oral Surg Oral Med Oral Pathol Oral Radiol,2014,117:227-233.
[13] TAN K S,ARMUGAM A,SEPRAMANIAM S,et al.Expression profile of MicroRNAs in young stroke patients[J].PLoS One,2009,4:e7689.
[14] LEE S T,CHU K,JUNG K H,et al.MicroRNAs induced during ischemic preconditioning[J].Stroke,2010,41:1 646-1 651.
[15] ZHAO Y Y,WANG W A,HU H.Treatment with recombinant tissue plasminogen activator alters the microRNA expression profiles in mouse brain after acute ischemic stroke[J].Neurol Sci,2015,36:1 463-1 470.
[16] LI P,TENG F,GAO F,et al.Identification of circulating microRNAs as potential biomarkers for detecting acute ischemic stroke[J].Cell Mol Neurobiol,2015,35:433-447.
[17] JICKLING G C,ANDER B P,ZHAN X,et al.microRNA expression in peripheral blood cells following acute ischemic stroke and their predicted gene targets[J].PLoS One,2014,9:e99283.
[18] SCHMITTGEN T D,LIVAK K J.Analyzing realtime PCR data by the comparative C(T) method[J].Nat Protoc,2008,3:1 101-1 108.
[19] PENG G,YUAN Y,WU S,et al.MicroRNA let-7e is a potential circulating biomarker of acute stage ischemic stroke[J].Transl Stroke Res,2015,6:437-445.
[20] ZHAO H,WANG J,GAO L,et al.MiRNA-424 protects against permanent focal cerebral ischemia injury in mice involving suppressing microglia activation[J].Stroke,2013,44:1 706-1 713.
[21] RECCHIONI R,MARCHESELLI F,OLIVIERI F,et al.Conventional and Novel Diagnostic Biomarkers of Acute Myocardial Infarction:A Promising Role for Circulating Micrornas[J].Biomarkers,2013,18:547-558.
[22] KAMPS J A,KRENNING G.Micromanaging Cardiac Regeneration:Targeted Delivery of Micrornas for Cardiac Repair and Regeneration[J].World J Cardiol,2016,8:163-179.
[23] ZHOU J,GAO J,ZHANG X,et al.Microrna-340-5p Functions Downstream of Cardiotrophin-1 to Regulate Cardiac Eccentric Hypertrophy and Heart Failure Via Target Gene Dystrophin[J].Int Heart J,2015,56:454-458.
[24] SYGITOWICZ G,TOMANIAK M,BLASZCZYK O,et al.Circulating Microribonucleic Acids Mir-1,Mir-21 and Mir-208a in Patients with Symptomatic Heart Failure:Preliminary Results[J].Arch Cardiovasc Dis,2015,108:634-642.
[25] KONTARAKI J E,MARKETOU M E,ZACHARIS E A,et al.Differential Expression of Vascular Smooth Muscle-Modulating Micrornas in Human Peripheral Blood Mononuclear Cells:Novel Targets in Essential Hypertension[J].J Hum Hypertens,2014,28:510-516.
[26] JIA L,HAO F,WANG W,et al.Circulating miR-145 is associated with plasma high-sensitivity C-reactive protein in acute ischemic stroke patients[J].Cell Biochem Funct,2015,33:314-319.
[27] ZHOU J,ZHANG J.Identification of miRNA-21 and miRNA-24 in plasma as potential early stage markers of acute cerebral infarction[J].Mol Med Rep,2014,10:971-976.
[28] ZIMNA A,KURPISZ M.Hypoxia-inducible factor-1 in physiological and pathophysiological angiogenesis:applications and therapies[J].Biomed Res Int,2015:549 412.
[29] DHIRAJ D K,CHRYSANTHOU E,MALLUCCI G R,et al.mi RNAs-19b,-29b-2*and-339-5p Show an Early and Sustained Up-Regulation in Ischemic Models of Stroke[J].PLoS One,2013,8(12):e83717.
[30] GAN C S,WANG C W,TAN K S.Circulatory micro RNA-145 expression is increased in cerebral ischemia[J].GMR,2012,11(1):147-152.
(收稿2019-01-16)
本文责编:夏保军
本文引用信息:王兴萍,王鹏,程度,何远宏,王建平.血清miR-155及缺氧诱导因子1α的表达对急性脑梗死的诊断价值[J].中国实用神经疾病杂志,2019,22(2):124-131.DOI:10.12083/SYSJ.2019.02.025
Reference information:WANG Xingping,WANG Peng,CHENG Du,HE Yuanhong,WANG Jianping.Diagnostic value of serum miR-155 and hypoxia-inducible factor 1α in acute cerebral infarction[J].Chinese Journal of Practical Nervous Diseases,2019,22(2):124-131.DOI:10.12083/SYSJ.2019.02.025