儿童脑损伤病因与癫痫关系的临床研究
张香敏 刘宗源 王 军 徐发林 韩 倩
郑州大学第三附属医院,河南 郑州 450052
基金项目:河南省医学科技攻关计划项目(编号:201702102)
作者简介:张香敏,Email:xiangmin0812@163.com
【摘要】 目的 探讨儿童脑损伤病因与癫痫的关系,为临床预防、早期干预儿童脑损伤提供理论依据。方法 回顾性分析郑州大学第三附属医院2013-01—2017-12治疗的1 194例癫痫患儿及同期1 194例非癫痫患儿的临床资料,探讨脑损伤病因与其发生癫痫的关系。结果 1 194例癫痫患儿中遗传性病因58例(4.9%),结构性病因449例(37.6%),代谢性病因22例(1.8%),感染性病因42例(3.5%),免疫性病因28例(2.4%),病因未明者595例(49.8%)。具体病因包括早产、新生儿低血糖、新生儿缺氧缺血性脑病(hypoxia-ischemic encephalopathy,HIE)、颅内出血、足月小样儿、新生儿高胆红素血症、先天性脑发育不良、遗传代谢病、新生儿重症感染、中枢神经系统感染、自身免疫性脑炎(autoimmune encephalitis,AE);其中癫痫的发生与新生儿HIE、早产、先天性脑发育不良、新生儿低血糖、中枢神经系统感染、AE均有关,且新生儿HIE、早产、新生儿低血糖是癫痫发生的独立危险因素。结论 儿童脑损伤病因与癫痫的发生相关,尤其新生儿HIE、早产、新生儿低血糖。临床医师应重视围生期保健,降低脑损伤发病率,早期干预脑损伤,对于降低癫痫的发病率具有重要的临床意义。
【关键词】 癫痫;脑损伤;早产;新生儿低血糖;新生儿缺氧缺血性脑病
【中图分类号】 R742.1 【文献标识码】 A 【文章编号】 1673-5110(2020)22-1949-07 DOI:10.12083/SYSJ.2021.03.014
Study on the relationship between the etiology of brain injury and epilepsy in children
ZHANG Xiangmin,LIU Zongyuan,WANG Jun,XU Falin,HAN Qian
The Third Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China
【Abstract】 Objective To explore the relationship between the etiology of children's brain injury and the occurrence of epilepsy,and provide theoretical basis for clinical prevention and early intervention of children's brain injury.Methods The clinical data of 1 194 children with epilepsy hospitalized in the Department of Pediatric Neurology from January 2013 to December 2017 in the Third Affiliated Hospital of Zhengzhou University and 1 194 children with non-epilepsy who were hospitalized in the Pediatric Department of our hospital during the same period were analyzed retrospectively.Results The results showed that among the 1 194 children with epilepsy,58(4.9%) were caused by genetic etiology,449(37.6%) by structural etiology,22(1.8%) by metabolic etiology,42(3.5%) by infection etiology,28(2.4%) by immune etiology,and 595(49.8%) by unknown etiology.Specific causes include:preterm delivery,neonatal hypoglycemia,neonatal hypoxic-ischemic encephalopathy (HIE),intracranial hemorrhage,small for gestational age,neonatal hyperbilirubinemia,congenital brain dysplasia,genetic metabolic diseases,neonatal severe infection,central nervous system infection and autoimmune encephalitis (AE).Among them,the occurrence of epilepsy is related to neonatal HIE,preterm birth,congenital brain dysplasia,neonatal hypoglycemia,central nervous system infection and AE,and neonatal HIE,preterm birth and neonatal hypoglycemia are independent risk factors for the occurrence of epilepsy.Conclusion The etiology of brain injury in children is related to epilepsy,especially HIE,preterm delivery and neonatal hypoglycemia.Therefore,clinicians should pay attention to perinatal health care,for reducing the incidence of brain injury.Moreover,early intervention of brain injury has important clinical significance for reducing the incidence of epilepsy.
【Key words】 Epilepsy;Brain injury;Preterm delivery;Neonatal hypoglycemia;Neonatal hypoxia-ischemic encephalopathy
脑损伤是儿科中枢神经疾病的常见病之一,严重危害婴幼儿的身体健康,导致脑损伤的病因包括早产、缺氧、高胆红素血症、颅内出血、低血糖、颅脑外伤、先天性脑发育不全、遗传代谢性疾病等。近年来随着新生儿复苏技术的不断提高及普及,生殖辅助技术的飞速发展,新生儿的成活率亦明显增加[1-2],同时由于各种脑损伤病因导致的一系列神经系统后遗症问题,如智力低下、脑性瘫痪、癫痫等亦更为突出,癫痫就是其中之一[3-5]。2017年国际抗癫痫联盟(International League Against Epilepsy,ILAE)推出了新的癫痫发作及癫痫病因分类,把癫痫病因分为遗传、代谢、结构、免疫、感染及原因不明六大类[6]。由于癫痫病因复杂,而婴幼儿大脑皮质发育不完善,容易受到外界因素,如缺氧、感染、颅内出血、严重高胆红素血症等的影响,因此脑损伤后容易继发癫痫,而癫痫以病程长和临床反复发作为特点,且发作类型复杂,临床不易控制,严重威胁患者的身心健康,癫痫发作给患者造成巨大的生理和心理上的痛苦,影响患者和家庭的生活质量,给家庭和社会带来沉重的经济负担及社会负担[7-8]。目前国内外有关儿童脑损伤病因与其癫痫关系的详细、全面报道甚少,而且临床医师对于各种儿童脑损伤病因与其发生癫痫的关系如何,目前仍存在认识上的不足,导致临床诊治过程中出现诊断不及时、不准确,从而延误治疗。因此,为了提高临床医师对儿童脑损伤病因与其发生癫痫关系的认识水平,本研究通过回顾性分析郑州大学第三附属医院2013-01—2017-12小儿神经内科住院治疗的1 194例癫痫患儿的病例资料,详细分析儿童脑损伤病因与其癫痫发生的关系,有利于及时正确诊断和治疗脑损伤,改善脑损伤的预后,对降低癫痫发病率起积极作用,同时为加强围生期保健、降低脑损伤发病率及早期干预脑损伤提供可靠的理论依据。
1 资料与方法
1.1 纳入对象 本研究为回顾性病例对照研究,选取郑州大学第三附属医院2013-01—2017-12小儿神经内科住院治疗的1 194例癫痫患儿为实验组。实验组纳入标准:(1)年龄29 d~18岁;(2)所有患儿符合2014年国际抗癫痫联盟癫痫的诊断标准[9];(3)排除病史表述不清及临床资料明显不全者。以同期住院治疗的1 194例患儿为对照组。对照组纳入标准:(1)年龄29 d~18岁;(2)无神经系统疾病史;(3)排除病史表述不清及临床资料明显不全者。本研究已征得患儿家长知情同意及经院医学伦理委员会批准。
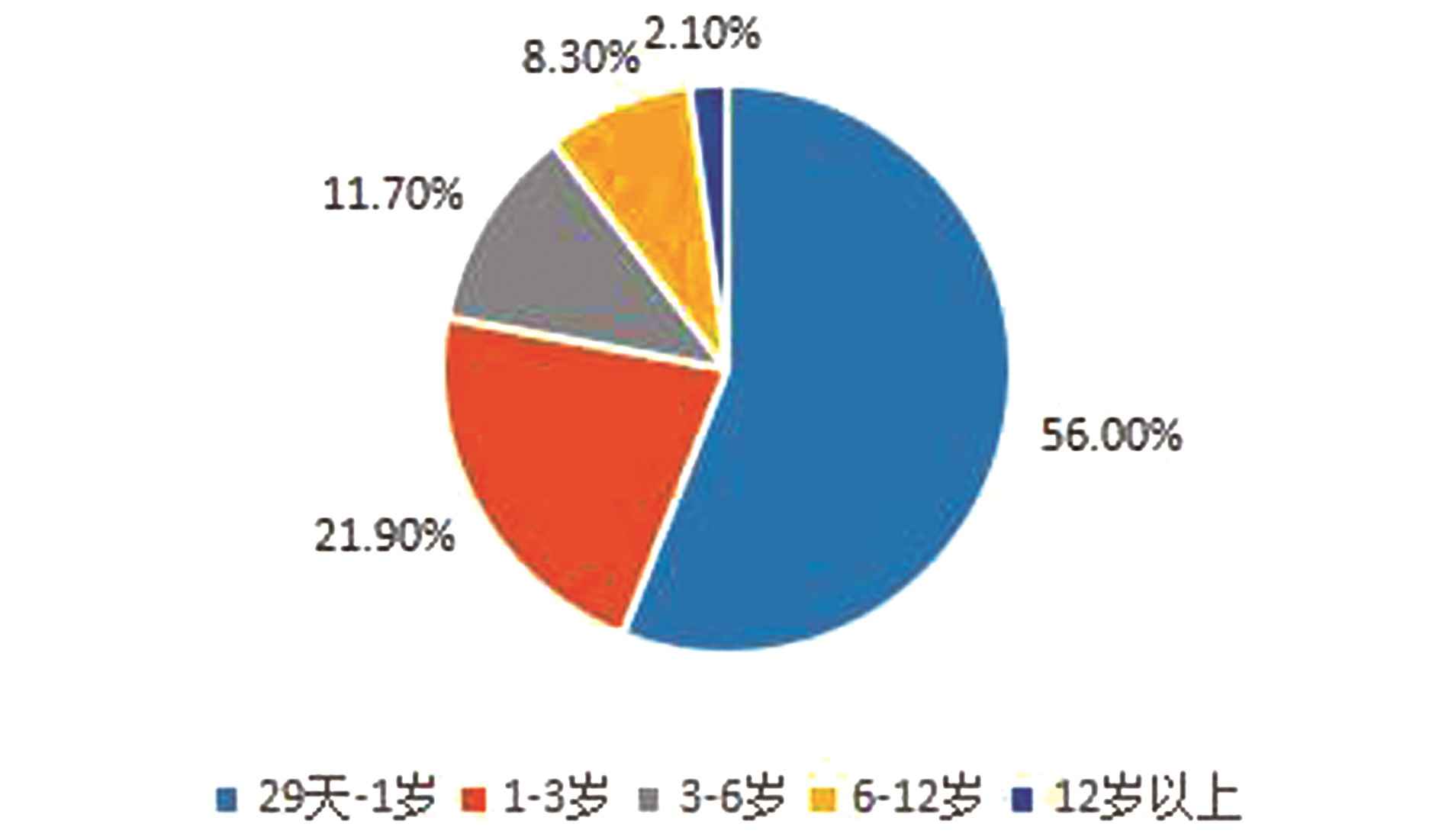
1.2 研究方法 回顾性分析1 194例实验组患儿的一般资料,包括性别、胎龄、出生体质量、分娩方式、家族遗传史、是否有新生儿期脑损伤高危因素、抽搐发作起始年龄、表现形式、是否确诊某种癫痫综合征、头颅影像学检查(图1A、B、C、D)、脑电图检查(图2~3)等相关临床资料。1 194例癫痫患儿中男653例(54.7%),女541例(45.3%),男女之比1.21∶1;自然分娩655例(54.9%),剖宫产539例(45.1%);胎龄26~44(38.13±2.01)周;出生体质量1.00~5.40(3.24±0.59)kg;最小29 d,最大15.8岁,29 d~1岁669例(56.0%),>1~3岁261例(21.9%),>3~6岁140例(11.7%),>6~12岁99例(8.3%),12岁以上25例(2.1%)(图4)。存在神经系统家族史者200例(16.8%)。对同期住院的对照组患儿的性别、胎龄、出生体质量、分娩方式等一般资料及是否有新生儿期脑损伤高危因素等相关临床资料进行分析。
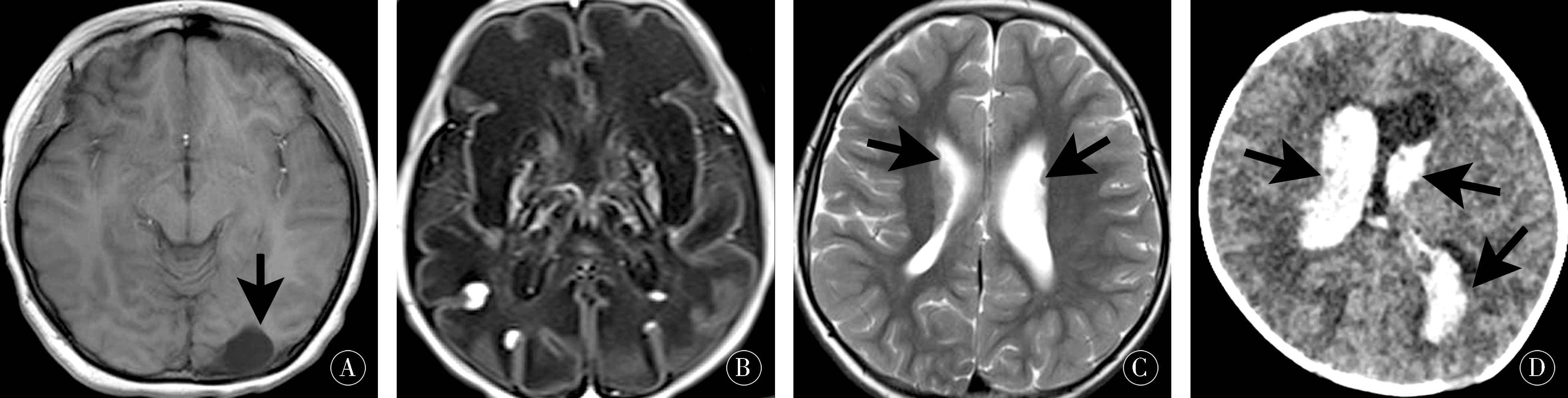
图1 脑部影像学检查典型病例 A:男,11岁,间断抽搐2 a余,MRI显示脑软化,T1加权像横截面,左枕叶片状高信号;B:男,4 h,33周早产儿,窒息复苏后呼吸困难4 h,MRI显示新生儿重度缺氧缺血性脑病-弥漫脑水肿,T1加权像横截面显示双侧大脑半球脑白质、基底节区、丘脑呈弥漫高信号;C:男,13岁,间断抽搐12 a,MRI 显示灰质异位,T1加权像横截面显示双侧脑室体旁见灰质信号团块;D:女,12 d,发热、呕吐1 d,CT提示脑室内Ⅳ级出血,横切面显示脑室系统内可见铸型高密度影,右侧小脑半球可见斑块状高密度影
Figure 1 Typical cases of brain imaging examination in children.A:Boy,11 years old,intermittent convulsion for more than 2 years.MRI showed cerebral softening,T1-weighted image cross-section showed high signal in left occipital leaf.B:Boy,4 hours,33 weeks premature infants,dyspnea 4 hours after asphyxia resuscitation,MRI showed severe hypoxic-ischemic encephalopathy-diffuse brain edema,T1-weighted cross section showed diffuse high signal intensity in white matter,and basal ganglia and thalamus of both hemispheres.C:A 13-year-old boy with intermittent convulsions for 12 years showed ectopic gray matter on MRI and a signal mass of gray matter around the body of bilateral ventricles on cross section of T1-weighted images.D:Girl,12 days,fever and vomiting 1 day,CT showed intraventricular Ⅳ grade hemorrhage,cross section showed cast high density shadow in the ventricular system,and plaque high density shadow could be seen in the right cerebellar hemisphere
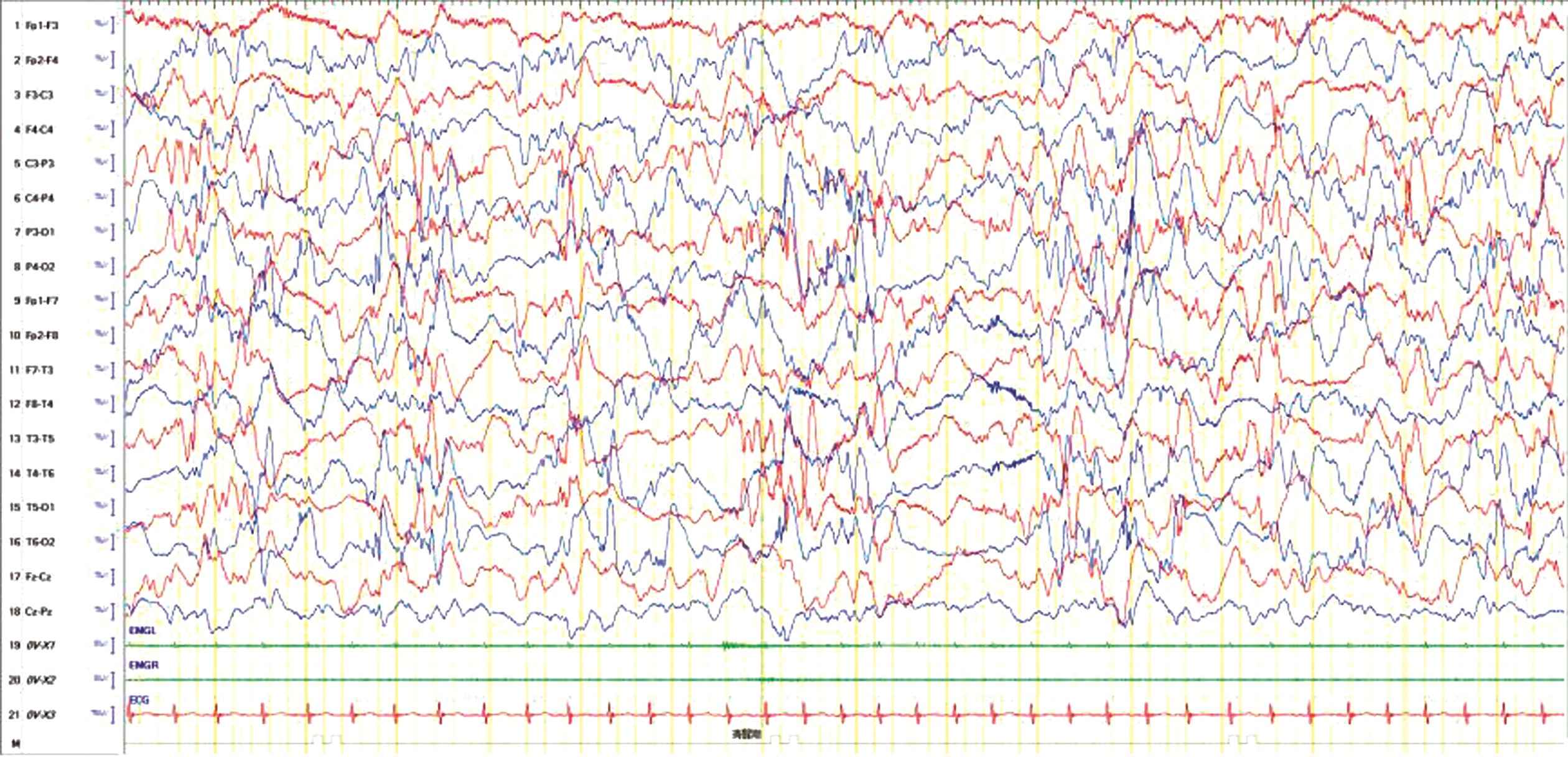
图2 女,5月龄,间断抽搐1月余伴智力运动发育倒退,脑电图提示高度失律,醒-睡各期可见弥漫性中-高幅慢波夹杂大量多灶性尖波、棘波,多棘波左右不对称且不同步发放,后头部显著
Figure 2 Girl,5 months old,had intermittent convulsions for more than one month with a retrogression of psychomotor development,and EEG showed a high degree of irregularity.Diffuse middle-high amplitude slow waves mixed with a large number of multifocal sharp waves,spike waves and multi-spike waves were seen in each stage of waking and sleeping,which were asymmetrical and unsynchronously released from the left and right sides of the spike waves,and the posterior head was significant
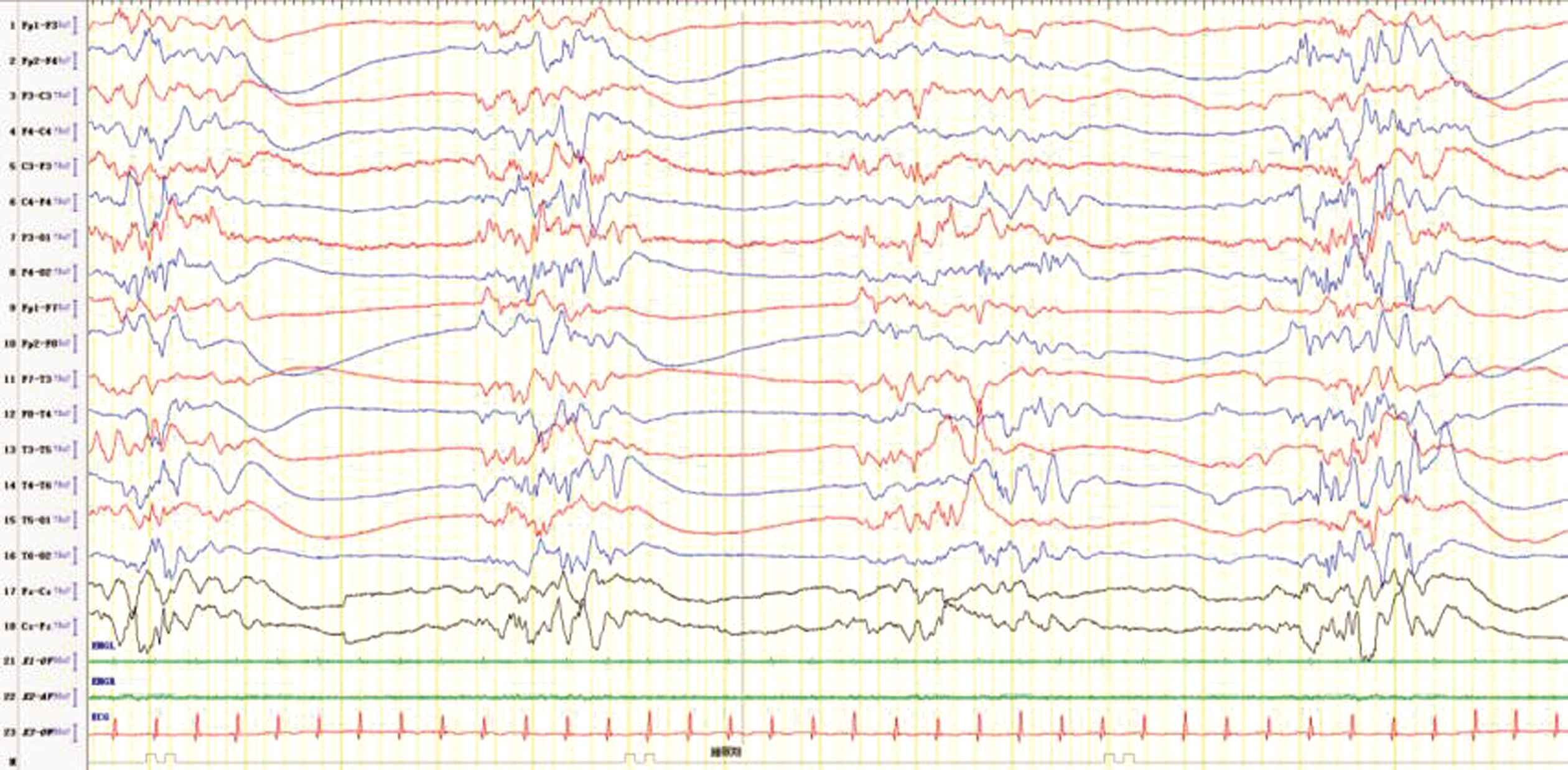
图3 男,39 d,生后间断抽搐1月余,脑电图提示爆发抑制,醒-睡各期可见中-高波幅不规则慢波夹杂多灶尖波、棘波与低平波幅交替周期性发作
Figure 3 Boy,39 days,intermittent convulsion for more than one month,EEG showed burst inhibition,medium-high amplitude irregular slow wave mixed with multifocal sharp wave,and spike wave and low flat amplitude alternately occurred periodically in each stage of waking and sleeping
图4 癫痫患儿起病年龄分布图
Figure 4 Age distribution of onset in children with epilepsy
1.3 统计学方法 采用SPSS 22.0 软件进行数据统计,计量资料采用均数±标准差表示;计数资料选用率(%)表示,采用χ2检验,对有关因素先行单因素分析,然后将单因素分析有统计学意义的变量行多因素Logistic回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 病因分类 1 194例癫痫患儿中行基因检测193例(16.2%),其中检测出明确致病基因58例(4.9%);所有患儿行影像学检查,其中有明确结构性病因者449例(37.6%);581例患儿行遗传代谢病筛查,明确代谢性病因者22例(1.8%);明确感染性病因患儿42例(3.5%),明确免疫性病因患儿28例(2.4%),发病原因未明患儿595例(49.8%)。具体病因如下:早产儿149例(12.5%),新生儿低血糖101例(8.5%),新生儿缺氧缺血性脑病(hypoxia-ischemic encephalopathy,HIE)35例(11.3%),颅内出血17例(1.4%),足月小样儿23例(1.9%),新生儿高胆红素血症33例(2.8%),先天性脑发育不全31例(2.6%),遗传代谢性疾病22例(1.8%),新生儿重症感染18例(1.5%),中枢神经系统感染42例(3.5%),自身免疫性脑炎(autoimmune encephalitis,AE)28例(2.4%)。
表1 不同病因在不同年龄阶段的发病情况
Table 1 The incidence of different causes in different age stages
| 病因 |
年龄 |
| 29 d~1岁 |
>1~3岁 |
>3~6岁 |
>6~12岁 |
12岁以上 |
| 遗传性病因 |
44 |
12 |
2 |
0 |
0 |
| 结构性病因 |
251 |
83 |
56 |
48 |
11 |
| 代谢性病因 |
12 |
5 |
3 |
2 |
0 |
| 免疫性病因 |
2 |
6 |
10 |
9 |
1 |
| 感染性病因 |
11 |
8 |
12 |
10 |
1 |
| 病因不明 |
238 |
147 |
106 |
90 |
14 |
2.2 临床表现 1 194例癫痫患儿中未归为癫痫综合征688例(57.6%),其发作类型分布:全面性发作305例(44.3%),局灶性发作361例(52.5%),起始不明发作22例(3.2%)。可归为癫痫综合征者506例,占42.4%(表1),其发作类型分布:全面性发作224例(44.3%),局灶性发作282例(55.7%)。患儿行头颅磁共振(MRI)检查1 080例,异常414例,MRI检测阳性率38.3%,行头颅CT检查114例,异常35例,CT检测阳性率30.7%。全部患儿行长程脑电图检查,847例异常,占71.0%。见表2~4。
表2 506例癫痫综合征类型分布
Table 2 Type distribution of 506 cases of epileptic syndrome
| 癫痫综合征类型 |
例数 |
百分比/% |
| 婴儿痉挛 |
97 |
19.2 |
| Lennox-Gastaut综合征 |
38 |
7.5 |
| Dravet综合征 |
11 |
2.2 |
| 伴中央颞区棘波儿童良性癫痫 |
115 |
22.7 |
| Doose综合征 |
10 |
2 |
| 大田园综合征 |
12 |
2.4 |
| 伴睡眠期持续棘慢波的癫痫性脑病 |
19 |
3.7 |
| 婴儿肌阵挛癫痫 |
2 |
0.4 |
| 青少年肌阵挛癫痫 |
9 |
1.8 |
| 热性惊厥附加症 |
26 |
5.1 |
| 儿童失神癫痫 |
30 |
5.9 |
| 早发性良性儿童枕叶癫痫(Panayiotopoulos型) |
15 |
3 |
| 迟发性儿童枕叶癫痫(Gastaut 型) |
6 |
1.2 |
| 良性婴儿癫痫 |
68 |
13.4 |
| 额叶癫痫 |
31 |
6.1 |
| 颞叶癫痫 |
17 |
3.4 |
表3 脑损伤病因与癫痫相关性的单因素分析
Table 3 Univariate analysis of the relationship between etiology of brain injury and epilepsy
| 因素 |
|
实验组 |
对照组 |
χ2值 |
R值 |
| 胎龄 |
早产 |
149 |
91 |
15.583 |
0 |
| |
足月 |
1 045 |
1103 |
|
|
| 新生儿低血糖 |
有 |
101 |
72 |
5.241 |
0.022 |
| |
无 |
1 093 |
1 122 |
|
|
| 新生儿HIE |
有 |
135 |
100 |
5.782 |
0.016 |
| |
无 |
1 059 |
1 094 |
|
|
| 颅内出血 |
有 |
17 |
20 |
0.247 |
0.619 |
| |
无 |
1 177 |
1 174 |
|
|
| 足月小样儿 |
有 |
23 |
21 |
0.093 |
0.761 |
| |
无 |
1 171 |
1 173 |
|
|
| 新生儿高胆 |
有 |
33 |
35 |
0.061 |
0.806 |
| 红素血症 |
无 |
1 161 |
1 159 |
|
|
| 先天性脑发育 |
有 |
31 |
0 |
31.408 |
0 |
| 不良 |
无 |
1 163 |
1 194 |
|
|
| 遗传代谢病 |
有 |
22 |
13 |
2.349 |
0.125 |
| |
无 |
1 172 |
1 181 |
|
|
| 新生儿重症感染 |
有 |
18 |
31 |
3.062 |
0.08 |
| |
无 |
1 176 |
1 163 |
|
|
| 中枢神经系统感染 |
有 |
42 |
0 |
42.752 |
0 |
| |
无 |
1 152 |
1 194 |
|
|
| 自身免疫性脑炎 |
有 |
28 |
0 |
28.332 |
0 |
| |
无 |
1 166 |
1 194 |
|
|
表4 脑损伤病因与癫痫相关性的多因素Logistic回归分析
Table 4 Multivariate Logistic regression analysis of the relationship between etiology of brain injury and epilepsy
| 因素 |
回归系数 |
标准误 |
Wald χ2 |
OR |
95% CI |
P值 |
| 新生儿HIE |
-0.606 |
0.143 |
18.065 |
0.546 |
0.413~0.722 |
0.001 |
| 先天性脑发育不良 |
-21.508 |
7 218.802 |
0.000 |
0.000 |
0.000 |
0.998 |
| 新生儿低血糖 |
-0.644 |
0.163 |
15.54 |
0.525 |
0.381~0.723 |
0.001 |
| 中枢神经系统感染 |
-21.494 |
6 195.082 |
0.000 |
0.000 |
0.000 |
0.997 |
| 早产儿 |
-0.799 |
0.144 |
30.964 |
0.45 |
0.340~0.596 |
0.000 |
| 自身免疫性疾病 |
-21.466 |
7 571.087 |
0.000 |
0.000 |
0.000 |
0.998 |
3 讨论
癫痫是儿科的常见病、多发病,癫痫发病率与年龄关系国内外报道不一[10],国内有报道儿童发病率较成年人高,其中又以1岁内发病率最高,随年龄增长发病率逐渐降低,15岁以后发病率趋于平稳且逐渐减少[11]。本研究表明29 d~1岁起病的患儿数量最多,占56.0%,后随年龄增长患儿数量逐渐减少,发病率亦逐渐减低。本组患儿男女之比1.21∶1,与多数国内外资料报道的癫痫患者男女比例(0.96~1.25∶1)基本一致[12-13]。
不同的分娩方式是否对小儿神经发育产生影响目前尚无统一定论。有学者提出[14],经产道分娩可能会增加新生儿脑出血的发生率,其可能是产道分娩时胎儿颅内压升高导致出血,可能还会引起颅脑短暂性的缺氧缺血,进而损伤脑神经。也有学者提出[15],自然分娩时规律宫缩及产道挤压可促进胎儿呼吸道内羊水排出,刺激呼吸中枢,减少窒息的发生,减少神经系统后遗症的可能性。本研究显示入组癫痫患儿自然分娩多于剖宫产,比例为1.22∶1,至于采取哪种分娩方式可能减轻脑损伤的发生,进而减少神经系统后遗症,仍需要进一步的研究。
新生儿HIE是围生期窒息导致的急性缺氧缺血性脑损伤,主要机制是缺氧影响线粒体功能,导致能量衰竭,进而导致细胞内一系列生化代谢过程紊乱,引起细胞水肿及组织缺血,最终可导致脑组织坏死[16-18],且能量代谢障碍可导致细胞内 Ca2+ 浓度增加,激活多种蛋白水解酶和磷脂酶,进而引起细胞内氧自由基增多,造成脑组织损伤,因此氧自由基的产生和线粒体功能障碍相互促进,共同引起脑组织损伤[19-21]。HIE可引起癫痫等后遗症已是国内外学者的共识[22-23],但鲜有报道进一步研究其相关性。本研究探讨的新生儿脑损伤病因中新生儿HIE是癫痫的独立危险因素,且患儿较多,可能与其损伤恢复较慢、治疗周期偏长,导致预后不佳有关[24]。因此,做好围生期保健、早期诊断及早期干预尤为重要,可有效降低癫痫的发病率。
本研究表明早产也是癫痫的独立危险因素,可能由于在早产儿脑血管发育不成熟的基础上出生前后及出生时内外环境变化出现局部脑组织的缺血或出血、炎症及细胞因子增多、脑组织缺血-再灌注损伤等,引起脑细胞损伤,最终导致早产儿出现神经系统后遗症[25]。先天性脑发育不良作为新生儿脑损伤的常见病因之一,本研究中与癫痫的发生有关,但不是癫痫的独立危险因素,其导致癫痫等神经系统后遗症的机制可能与谷氨酸受体(NMDA)亚单位异常导致的脑细胞电生理异常有关,但具体机制仍需进一步研究阐明[26]。
新生儿低血糖是新生儿期常见的一种代谢紊乱性疾病[27],本研究表明新生儿低血糖是癫痫的独立危险因素。轻度的持续时间较短暂的低血糖和易纠正的低血糖几乎不会造成脑损伤,但严重的或持续性低血糖可导致新生儿脑组织中葡萄糖浓度下降,由于脑组织耗氧量大,因此当发生低血糖时脑组织最先受累而引起脑损伤,甚至引起癫痫等神经系统后遗症[28-30]。因此早期识别新生儿低血糖,及时监测、干预和治疗,防止出现严重的或持续性低血糖,临床可有效降低癫痫的发病率。
中枢性神经系统感染是由细菌、病毒、寄生虫、螺旋体以及真菌等多种病原体引起,病原体可对患者的中枢神经系统造成损害,引起脑结构发生变化,从而导致患者脑功能障碍,可增加癫痫风险[31]。而自身免疫性脑炎泛指一类由自身免疫机制介导的脑炎,其中抗NMDAR受体脑炎被认为是儿童中最常见的自身免疫性脑炎[32-33]。本研究表明中枢神经系统感染和自身免疫性脑炎均与与癫痫有关,因此提醒临床医师加强对这两种疾病的认识,早期识别、早期诊断、早期治疗,避免误诊,减少不良预后的发生。
癫痫的发生与HIE、早产、先天性脑发育不良、新生儿低血糖、中枢神经系统感、AE均有关,且HIE、早产、新生儿低血糖是癫痫发生的独立危险因素。因此,临床医师应提高对儿童脑损伤病因与其发生癫痫关系的认识,早期发现、早期干预治疗,从而最大限度减少癫痫的发病率。由于癫痫病因复杂,加之本次研究样本量有限,脑损伤病因与癫痫的关系仍未完全阐明,因此,在将来的研究中还需进一步扩大样本量,进一步深入探讨脑损伤病因与其发生癫痫的关系,为临床诊断及治疗脑损伤、降低癫痫的发病率提供更加可靠的理论依据。
4 参考文献
[1] SCHMLZER G M,MORLEY C J,KAMLIN O C O F.Enhanced monitoring during neonatal resuscitation[J].SeminarPerinatology,2019,43(8):151177.DOI:10.1053/j.semperi.2019.08.006.
[2] PEJOVIC N J,HK S M,BYAMUGISHA J,et al.Neonatal resuscitation using a supraglottic airway device for improved mortality and morbidity outcomes in a low-income country:study protocol for a randomized trial[J].Trials,2019,20(1):444.DOI:10.1186/s13063-019-3455-8.
[3] SCHMITZ T,MARGGRAF K,BUEHRER C,et al.Neonatal Hyperoxia Perturbs Neuronal Development in the Cerebellum[J].Mol Neurobiol,2018,55(5):3901-3915.DOI:10.1007/s12035-017-0612-5.
[4] DUNBAR M,KIRTON A.Perinatal Stroke[J].Semin Pediatr Neurol,2019,32.DOI:10.1016/j.spen.2019.08.003.
[5] MURTHY P,ZEIN H,THOMAS S,et al.Neuroprotection Care Bundle Implementation to Decrease Acute Brain Injury in Preterm Infants[J].Pediatr Neurol,2020,110:42-48.DOI:10.1016/j.pediatrneurol.2020.04.016.
[6] SCHEFFER I E,BERKOVIC S,CAPOVILLA G,et al.ILAE classification of the epilepsies:Position paper of the ILAE Commission for Classification and Terminology[J].Epilepsia,2017,58:512-521.DOI:10.1111/epi.13709.
[7] VINKELES MELCHERS N V S,MOLLENKOPF S,OLEBUNDERS R,et al.Burden of on chocerciasis-associated epilepsy:first estimates and research priorities[J].Infect Dis Poverty,2018,7(1):101101.DOI:10.1186/s40249-018-0481-9.
[8] CARLSON J M,MILLER P A.Family burden,child disability,and the adjustment of mothers caring for children with epilepsy:Role of social support and coping[J].Epilepsy Behav,2017,68:168-173.DOI:10.1016/j.yebeh.2017.01.013.
[9] FISHER R S,ACEVEDO C,ARZIMANOGLOU A,et al.ILAE official report:a practical clinical definition of epilepsy[J].Epilepsia,2014,55(4):475-482.DOI:10.1111/epi.12550.
[10] FIEST K M,SAURO K M,WIEBE S,et al.Prevalence and incidence of epilepsy:A systematic review and meta-analysis of international studies[J].Neurology,2017,88(3):296-303.DOI:10.1212/WNL.00000000 00003509.
[11] JIANG Y S,SONG T T,ZHANG X G,et al.Clinical analysis of seizure types of epilepsy and epileptic syndrome in 345 children[J].J Clin Pediatr,2019,737(11):812-815.DOI:10.3969/j.issn.1000-3606.2019.11.004.
[12] ACKERMANN S,LE ROUX S,WILMSHURST J M.Epidemiology of children with epilepsy at a tertiary referral centre in South Africa[J].Seizure,2019,70:82-89.DOI:10.1016/j.seizure.2019.06.018.
[13] WANG X Y,LIU H W,FENG Y Q.Epidemiological investigation of epilepsy in children in Hohhot[J].Educ Teaching Forum,2018(33):232-233.
[14] ABIRAMALATHA T,KUMAR M,CHANDRAN S,et al.Troponin-T as a biomarker in neonates with perinatal asphyxia[J].J Neonatal Perinatal Med,2017,10(3):275-280.DOI:10.3233/NPM-16119.
[15] MCKINNEY J R,ALLSHOUSE A A,HEYBORNE K D.391:Duration of labor and maternal and neonatal morbidity[J].Am J Obstetr Gynecol,2018,218(1):S240-S240.DOI:10.1016/j.ajog.2017.10.327.
[16] PEMBEGÜL Y E,BARIŞ E,BURAK T.Neonatal hypoxic ischemic encephalopathy:an update on disease pathogenesis and treatment[J].Exp Rev Neurotherap,2017,17(5):449-459.DOI:10.1080/14737175.2017.1259567.
[17] ZAHID M,KHAN A H,YUNUS Z M,et al.Inherited metabolic disorders presenting as hypoxic ischaemic encephalopathy:A case series of patients presenting at a tertiary care hospital in Pakistan[J].JPMA,2019,69(3):432-436.
[18] SAITO B M,CODY S,DINEEN F,et al.Impact of Education on Hypothermia Delivery during Neonatal Transport[J].Neonatology,2019,116(1):20-26.DOI:10.1159/000495688.
[19] SCOTT J,ESPINOZA L,BASHIR R A,et al.Prevalence and Characteristics of Intracranial Hemorrhages in Neonates with Hypoxic Ischemic Encephalopathy[J].Am J Perinatol,2018,35(7):676-681.DOI:10.1055/s-0037-1608927.
[20] CHEN H M,GAO L X,WANG J J,et al.The correlation between AGT gene polymorphism and neonatal hypoxic-ischemic encephalopathy (HIE)[J].Eur Rev Med Pharmacol Sci,2019,23(5):2194-2199.DOI:1026355/eurrev_201903_17266.
[21] YSTGAARD M B,SCHEFFLER K,SUGANTHAN R,et al.Neuromodulatory Effect of NLRP3 and ASC in Neonatal Hypoxic Ischemic Encephalopathy[J].Neonatology,2019,115(4):355-362.DOI:10.1159/000497200.
[22] WANG Z,LIU Y,SHAO M,et al.Combined prediction of miR-210 and miR-374a for severity and prognosis of hypoxic–ischemic encephalopathy[J].Brain Behav,2018,8(1):e00835.DOI:10.1002/brb3.835.
[23] WILLIAMS T S,MCDONALD K P,ROBERTS S D,et al.Understanding Early Childhood Resilience Following Neonatal Brain Injury From Parents’ Perspectives Using a Mixed-Method Design[J].J Int Neuropsychol Soc,2019,25(4):390-402.DOI:10.1017/S1355617719000079.
[24] SIMIYU I N,MCHAILE D N,KATSONGERI K,et al.Prevalence,severity and early outcomes of hypoxic ischemic encephalopathy among newborns at a tertiary hospital,in northern Tanzania[J].BMC Pediatr,2017,17(1)131.DOI:10.1186/s12887-017-0876-y.
[25] GALINSKY R,LEAR C A,DEAN J M,et al.Complex interactions between hypoxia-ischemia and inflamma-tion in preterm brain injury[J].Dev Med Child Neurol,2018,60(2):126-133.DOI:10.1111/dmcn.13629.
[26] HANAK T J,LIBBEY J E,DOTY D J,et al.Positive modulation of mGluR5 attenuates seizures and reduces TNF-α+macrophages and microglia in the brain in a murine model of virus-induced temporal lobe epilepsy[J].Exp Neurol,2018,311:194-204.DOI:10.1016/j.expneurol.2018.10.006.
[27] DIPTI K,SIDHARTH,SUVASINI S,et al.Electroclinical spectrum of childhood epilepsy secondary to neonatal hypoglycemic brain injury in a low resource setting:A 10-year experience[J].Seizure,2020,79:1059-1311.DOI:10.1016/j.seizure.2020.05.010.
[28] ROZANCE P J,WOLFSDORF J I.Hypoglycemia in the Newborn[J].Pediatr Clin North Am,2018.DOI:10.1016/j.pcl.2018.12.004.
[29] PUCHALSKI M L,RUSSELL T L,KARLSEN K A.Neonatal Hypoglycemia[J].Crit Care Nurs Clin North Am,2018,30(4):467-480.DOI:10.1016/j.cnc.2018.07.004.
[30] SHAH R,HARDING J,BROWN J,et al.Neonatal Glycaemia and Neurodevelopmental Outcomes:A Systematic Review and Meta-Analysis[J].J Paediatr Child Health,2019,115(2):116-126.DOI:10.1111/jpc.14409_123.
[31] ABID F B,ABUKHATTAB M,SALAMEH O,et al.Viral infections of the central nervous system in Qatar:epidemiology,pathogenesis and clinical outcomes[J].Open Forum Infect Dis,2017,4(1):305.DOI:10.3855/jidc.10156.
[32] DUBEY D,PITTOCK S J,KELLY C R,et al.Autoimmune encephalitis epidemiology and a comparison to infectious encephalitis[J].Ann Neurol,2018,83(1):166-177.DOI:10.1002/ana.25131.
[33] DALMAU J,GRAUS F.Antibody-mediated encephalitis[J].N Enhgl J Med,2018,378(9):840-851.DOI:10.1056/NEJMra1708712.
(收稿 2020-09-04)
本文责编:夏保军
本文引用信息:张香敏,刘宗源,王军,徐发林,韩倩.儿童脑损伤病因与癫痫关系的临床研究[J].中国实用神经疾病杂志,2020,23(22):1949-1955.DOI:10.12083/SYSJ.2021.03.014
Reference information:ZHANG Xiangmin,LIU Zongyuan,WANG Jun,XU Falin,HAN Qian.Study on the relationship between the etiology of brain injury and epilepsy in children[J].Chinese Journal of Practical Nervous Diseases,2020,23(22):1949-1955.DOI:10.12083/SYSJ.2021.03.014