目的 探讨下调糖原合酶激酶3β(GSK-3β)活性对脑缺血再灌注大鼠学习记忆障碍改善作用的机制。方法 30只SD大鼠随机分为空白对照组、模型组、SB组,采用大脑中动脉线栓法(MACO)将模型组、SB组大鼠进行缺血再灌注造模,并予以SB组大鼠尾静脉注射SB216763(SB)后,对3组大鼠进行水迷宫测试、电跳台测试,进一步采用电生理检测海马CA3区海马长时程增强(LTP),检测皮质和海马cAMP反应元件结合蛋白(CREB)、β-连环蛋白(β-catenin)水平和磷酸化及NR2A/B的蛋白水平,检测脑组
下调糖原合酶激酶3β活性改善脑缺血再灌注大鼠学习记忆障碍的机制研究
王毅华1,2) 陈真珍1,3) 谭文澜1) 曾 振1) 姚秀卿1) 王凯华1)△
1)广西中医药大学附属瑞康医院神经内科,广西 南宁 530011 2)北海市中医医院,广西 北海 536000 3)广西中医药大学,广西 南宁 530000
基金项目:广西自然科学基金青年基金资助(编号:2012GXNSFBA053082);广西中医药大学研究生教育创新计划资助项目(编号:YJSP201742)
△通信作者:王凯华(1980-),男,医学博士,副主任医师。研究方向:血管性认知功能障碍的防治。Email:67232624@qq.com
【摘要】 目的 探讨下调糖原合酶激酶3β(GSK-3β)活性对脑缺血再灌注大鼠学习记忆障碍改善作用的机制。方法 30只SD大鼠随机分为空白对照组、模型组、SB组,采用大脑中动脉线栓法(MACO)将模型组、SB组大鼠进行缺血再灌注造模,并予以SB组大鼠尾静脉注射SB216763(SB)后,对3组大鼠进行水迷宫测试、电跳台测试,进一步采用电生理检测海马CA3区海马长时程增强(LTP),检测皮质和海马cAMP反应元件结合蛋白(CREB)、β-连环蛋白(β-catenin)水平和磷酸化及NR2A/B的蛋白水平,检测脑组织CREB、β-catenin及NR2A/B的分布,皮质和海马 CREB、β-catenin和NR2A/B的mRNA水平。结果 模型组水迷宫测试、电跳台测试均较空白对照组差(P<0.01),SB组水迷宫测试、电跳台测试均优于模型组(P<0.05或0.01);模型组与空白对照组比较,高频刺激后峰电位幅值和兴奋性突触后电位(EPSP)斜率均明显减小(P<0.01),SB组与模型组比,高频刺激后峰电位幅值和EPSP斜率均增大(P<0.01);SB组皮质和海马CREB、β-catenin及NR2A/B的蛋白水平均高于模型组(P<0.05或0.01);SB组皮质和海马CREB、β-catenin的磷酸化水平低于模型组(P<0.05);CREB、β-catenin 及NR2A/B主要分布于大脑海马组织;SB组皮质和海马CREB、β-catenin和NR2A/B的mRNA水平均高于模型组(P<0.05或0.01)。结论 下调糖原合酶激酶 3β活性可通过增强LTP、增加脑组织CREB、β-catenin和NR2A/B的表达,从而对脑缺血再灌注大鼠的学习记忆障碍起到改善的作用。
【关键词】 糖原合酶激酶3β;cAMP反应元件结合蛋白;β-连环蛋白;脑缺血再灌注;学习记忆;海马;皮质;大鼠
【中图分类号】 R-332 【文献标识码】 A 【文章编号】 1673-5110(2018)06-0581-07 DOI:10.12083/SYSJ.2018.06.149
The mechanism study of down-regulation of glycogen synthase kinase 3β to improvement the ability of learning and memory of the ischemia-reperfusion model of rats
WANG Yihua1,2),CHEN Zhenzhen1,3),TAN Wenlan1),ZENG Zhen1),YAO Xiuqing1),WANG Kaihua1)
1)Department of Neurology,Ruikang Hospital Affiliated to Guangxi University of Chinese Medicine,Nanning 530011,China;2)Beihai Hospital of Traditional Chinese Medicine,Beihai 536000,China;3)Guangxi University of Chinese Medicine,Nanning 530000,China
【Abstract】 Objective To study the mechanism of the down-regulation of glycogen synthase kinase 3β(GSK-3β)to improvement the ability of learning and memory of the ischemia-reperfusion model of rats.Methods The 30 SD rats were divided randomly into the control group,model group and SB group.The model group and the SB group were created into the ischemia-reperfusion model by right middle cerebral artery occlusion (MCAO).After tail vein injection the SB216763 (SB) to the SB group,all of the groups were tested with the Morris water maze test and step-down avoidance test,tested the long-term potentiation (LTP) in hippocampus CA3 region by electrophysiology detection.More,all of the groups were detected the level of protein of CREB,β-catenin and NR2A/B,and the level of phosphorylation of CREB and β-catenin in the cortex and hippocampus,detected the distribution of the CREB,β-catenin and NR2A/B in the cerebral tissue,detected the level of mRNA of the CREB,β-catenin and NR2A/B in the cortex and hippocampus.Results Both of the data of the Morris water maze test and step-down avoidance test of the model group were worse than the control group (P<0.01),the same test of the SB group,were better than the model group (P<0.05 or P<0.01).Both of the amplitude of spike potential after high frequency stimulating and the slope of excitatory postsynaptic potential (EPSP) of model group were lower than control group (P<0.01).Both of the amplitude of spike potential after high frequency stimulating and the slope of EPSP of SB group were higher than model group (P<0.01).All of the level of protein of CREB,β-catenin and NR2A/B in the cortex and hippocampus of SB group were higher than the model group (P<0.05 or P<0.01).Both of the level of phosphorylation of CREB and β-catenin in the cortex and hippocampus of SB group were lower than the model group (P<0.05).CREB,β-catenin and NR2A/B mainly distribute to the hippocampus in the cerebrum.All of the level of mRNA of CREB,β-catenin and NR2A/B in the cortex and hippocampus of SB group were higher than the model group (P<0.05 or P<0.01).Conclusion Down-regulation of GSK-3β might improve the ability of learning and memory of the ischemia-reperfusion model of rats by increasing the production of LTP,CREB,β-catenin and NR2A/B in the cerebrum.
【Key words】 Glycogen synthase kinase 3β;cAMP responsive elementbinding protein;β-catenin;Ischemia-reperfusion;Learning and memory;Hippocampus;Cortex;Rats
脑组织对缺血、缺氧非常敏感。随着社会老年化趋势和人均寿命的延长,缺血性脑血管疾病的发病率明显上升,是一种严重危害中老年人身心健康的常见病、多发病,给社会和家庭带来沉重负担[1]。脑缺血再灌注引起的认知功能障碍日益受到人们的重视。大量的临床和动物实验显示,脑缺血和再灌注损伤可导致显著的学习记忆障碍[2-3],而其发生机制尚未彻底阐明,且需要漫长的的治疗过程[4]。
研究表明,脑缺血再灌时糖原合酶激酶3(glycogen synthase kinase 3,GSK-3)明显增加;多种药物治疗脑缺血再灌注后,GSK-3β活性下降,而直接抑制 GSK-3β活性,可明显改善脑缺血再灌大鼠的学习记忆障碍[5-6]。但其作用机制目前国内外尚未见类似的研究报道。本研究首次研究下调糖原合酶激酶3β活性对脑缺血再灌注大鼠学习记忆障碍改善作用,并进一步揭示其作用机制。
1 材料与方法
1.1 动物分组 SD成年雄性大鼠24只(由广西中医药大学实验动物中心提供),体质量(240±30)g(普通级),随机分为空白对照组、模型组、SB组。
1.2 脑缺血再灌注大鼠模型建立 将模型组及SB组大鼠予以10%水合氯醛按3.5 mg/kg进行腹腔内注射麻醉,仰卧位固定,沿颈正中线切开,分离右侧颈总动脉、颈外动脉及颈内动脉,于距离颈总动脉分叉处4 mm点剪一小口,将栓线插入到颈内动脉,从而使右侧大脑中动脉的血流中断。将栓线固定好后,逐层缝合切口并予以消毒。在右侧大脑中动脉血流阻断60 min后,拔除线栓,使右侧大脑中动脉实现缺血后再灌注,并以大鼠苏醒后出现偏瘫为造模成功。空白对照组不予以上述操作。
1.3 尾静脉注射 于再灌注开始时予以SB组大鼠尾静脉注射GSK-3β的特异性抑制剂SB216763(SB),1次/d,连续2 d。
1.4 Morris水迷宫测试 测试空间学习记忆能力。于缺血再灌注48 h后对所有大鼠进行检测。水迷宫的水温保持在23 ℃左右,水被染成白色,从而隐蔽平台。实验分为训练期和测试期。训练时,将大鼠背对平台放入水中,记录大鼠从入水到找到水下隐蔽的平台所需要的时间为逃避潜伏期。第2天的训练较第1天前进一个象限入水,依此类推。完成训练后,测试时撤去平台。2次测试均记录大鼠的平台范围时间比。
1.5 电跳台测试 测试情绪学习记忆能力。将大鼠分别置入反应箱中,予以箱底不锈钢栅通交流电,电压36 V,实验时间5 min,大鼠遭到电击后,正常反应为跳到安全台上躲避,以躲避伤害,如果再次从安全台上跳下触及不锈钢栅则为错误反应。大鼠受电击后第1次跳上安全台的时间为反应时间,5 min内跳下安全台的次数为错误次数。测试成绩作为学习成绩。24 h后,将大鼠直接置于安全台上,并予以不锈钢栅通电36 V,大鼠第1次从安全台跳下的时间为潜伏时间,大鼠跳下安全台的次数则为错误次数。第2天测试成绩为记忆成绩。
1.6 电生理检测长时程增强(long-term potentia-tion,LTP) 完成行为学检测后,进行电生理检测海马CA3区LTP形成。用乌拉坦予以大鼠腹腔麻醉(1 g/kg)后,切开大鼠头皮。取俯卧位将大鼠头部固定于脑立体定位仪,调节高度使前囟高于后囟1 mm。将双极刺激电极置于穿通纤维处(前囟后6.9~7.0 mm,旁开4.3~4.4 mm,深5.0~5.3 mm),用单个电脉冲(测试刺激,波宽0.15 ms,强度30 V)刺激,在海马CA3区(前囟后3.3~3.4 mm,旁开3.3~3.5 mm,深3.5~3.8 mm)记录诱发的群体峰电位;记录到群体峰电位后给穿通纤维以短串高频刺激(500 Hz,30 V,波宽0.15 ms,串长100 ms×2串),再记录群体峰电位幅度的变化。
1.7 Western-Blots方法 采用 Western-Blots方法检测皮质和海马cAMP反应元件结合蛋白(cAMP responsive elementbinding protein,CREB)、β-连环蛋白(β-catenin)水平和磷酸化及NR2A/B的蛋白水平。取各组大鼠皮质和海马组织,按照每1 mg组织加入10 μL细胞裂解液的比例,再取PMSF及磷酸酶抑制剂各10 μL,进行混合研磨,在4 ℃的条件下进行离心,取上清液进行蛋白水平及磷酸化水平的测定。检测结果采取光密度法进行定量,以确定大鼠皮质和海马CREB、β-catenin的水平和磷酸化及NR2A/B的蛋白水平。
1.8 免疫组化染色 采用免疫组化方法检测脑组织CREB、β-catenin及NR2A/B的分布。将大鼠脑组织切片,予以3 mL/L的过氧化氢(H2O2)经过30 min处理,使得内源性过氧化物酶封闭;在室温条件下,处理1 h,以封闭正常羊血清;在4 ℃条件下,予以兔抗CREB抗体、抗β-catenin抗体和抗NR2A/B抗体经过48 h处理;取生物素化羊兔抗体在室温条件下予以2 h处理;在室温条件下,予以SP复合物经过2 h处理;以上各个步骤均采用浓度为0.1 mol/L的PBS进行漂洗;显色;装裱片子;脱水;透明化;并予以封片,于光学显微镜下观察,细胞结构呈黄色显色的为阳性。
1.9 荧光定量PCR 采用荧光定量PCR检测皮质和海马CREB、β-catenin和NR2A/B的mRNA水平。取各组大鼠的大脑皮质及海马组织,用TRIzol发抽取RNA,再依据逆转录试剂盒说明将RNA逆转录为cDNA。采用3-磷酸甘油醛脱氢酶基因作为该实验的内参物,采用CREB、β-catenin和NR2A/B的相应引物对三者的mRNA水平表达进行检测,并对图像进行分析、比对。
1.10 统计学方法 所有数据以均数±标准差( x±s)表示,采用SPSS 20.0 软件进行分析,2组间比较用t检验;多组间数据比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
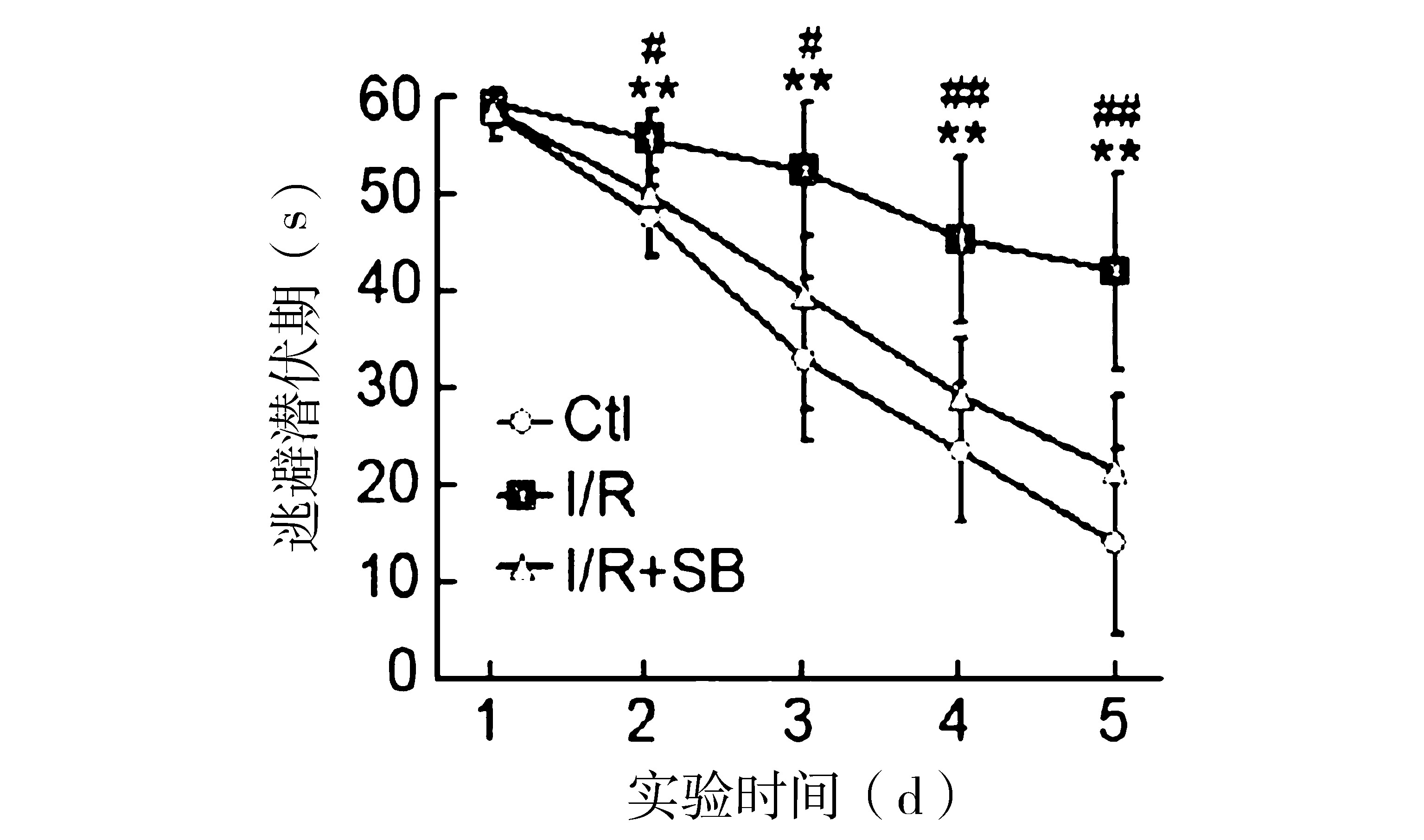
2.1 水迷宫测试 对空白对照组、模型组、SB组分别进行水迷宫测试。模型组从第2天开始逃避潜伏期显著长于空白对照组(P<0.01);SB组从第2天开始逃避潜伏期短于模型组(P<0.05),随着时间增加,逃避潜伏期的差距越来越显著(第4天及第5天,P<0.01)。见图1。
注:模型组(I/R)与空白对照组(Ctl)逃避潜伏期比较,**P<0.01;SB对照组(I/R+SB)与模型组比较,#P<0.05,##P<0.01
图1 空白对照组、模型组、SB组大鼠水迷宫测试结果比较
2.2 电跳台测试 对空白对照组、模型组、SB组进行电跳台测试,SB组反应时间长于空白对照组(P<0.05),模型组明显长于空白对照组(P<0.01),SB组明显短于模型组(P<0.01);SB组第1天错误次数多于空白对照组(P<0.05),模型组明显多于空白对照组(P<0.01),SB组明显少于模型组(P<0.01);SB组潜伏时间短于空白对照组(P<0.05),模型组明显短于空白对照组(P<0.01),SB组明显长于模型组(P<0.01);SB组第2天错误次数多于空白对照组(P<0.05),模型组明显多于空白对照组(P<0.01),SB组明显少于模型组(P<0.01)。见表1。
表1 空白对照组、模型组、SB组电跳台测试结果比较
| 组别 |
n |
学习(第1天) |
|
记忆(第2天) |
| 时间(s) |
错误(次数) |
|
时间(s) |
错误(次数) |
| 空白对照组 |
10 |
22.12±7.98 |
2.76±1.43 |
|
132.71±20.14 |
4.11±2.89 |
| 模型组 |
10 |
69.51±15.62△ |
6.96±3.54△ |
|
75.19±16.27△ |
6.32±2.93△ |
| SB组 |
10 |
39.76±10.44○● |
3.95±2.18○● |
|
117.88±19.28○● |
4.91±2.76○● |
注:与空白对照组比较,○P<0.05,△P<0.01;与模型组比较,●P<0.01
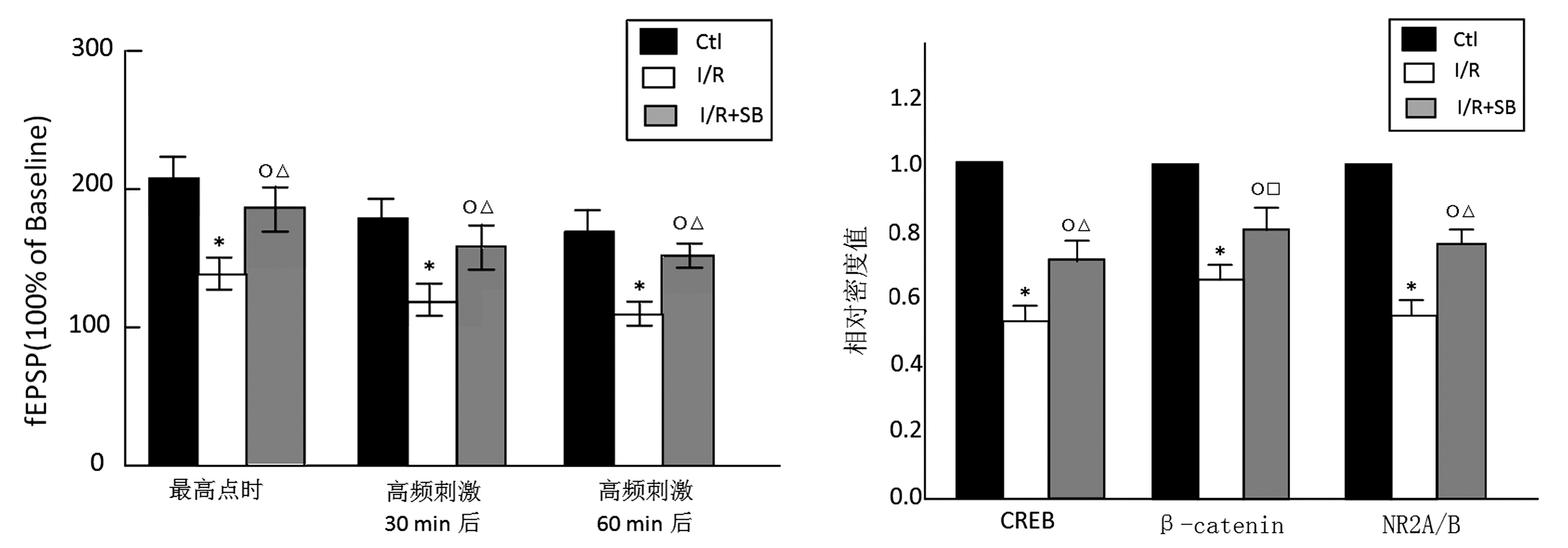
2.3 电生理检测LTP 对空白对照组、模型组、SB组海马组织CA3区进行电生理检测LTP。在高频刺激后最高点、30 min和60 min时,空白对照组fEPSP斜率与基础斜率相比,分别为(205.12±16.42)%、(188.52±12.35)% 和(173.31±13.15)%;模型组分别为(135.47±14.78)%、(119.42±12.92)% 和(112.21±9.53)%;SB组分别为(189.45±15.87%)、(158.71±15.42)% 和(152.79±13.48)%。空白对照组与模型组各个时间点间fEPSP斜率相比差异有统计学意义(P<0.01);SB组与空白对照组各个时间点间fEPSP斜率相比差异有统计学意义(P<0.05);SB组与模型组各个时间点间fEPSP斜率相比差异有统计学意义(P<0.01)。见图2。
2.4 检测皮质和海马CREB、β-catenin及NR2A/B的蛋白水平 模型组皮质和海马CREB、β-catenin及NR2A/B的蛋白水平均显著低于空白对照组(P<0.01);SB组皮质和海马β-catenin的蛋白水平高于模型组(P<0.05),CREB、NR2A/B的蛋白水平均显著高于模型组(P<0.01);SB组皮质和海马 CREB、β-catenin及NR2A/B的蛋白水平均低于空白对照组(P<0.05)。见图3。注:与相同时间点空白对照组比较,*P<0.01,○P<0.05;与相同时间点模型组比较,△P<0.01
图2 空白对照组、模型组、SB组大鼠电生理检测海马CA3区LTP结果比较 注:与空白对照组比较,*P<0.01,○P<0.05;与模型组比较,△P<0.01,□P<0.05
图3 空白对照组、模型组、SB组皮质和海马CREB、β-catenin及NR2A/B的蛋白水平比较
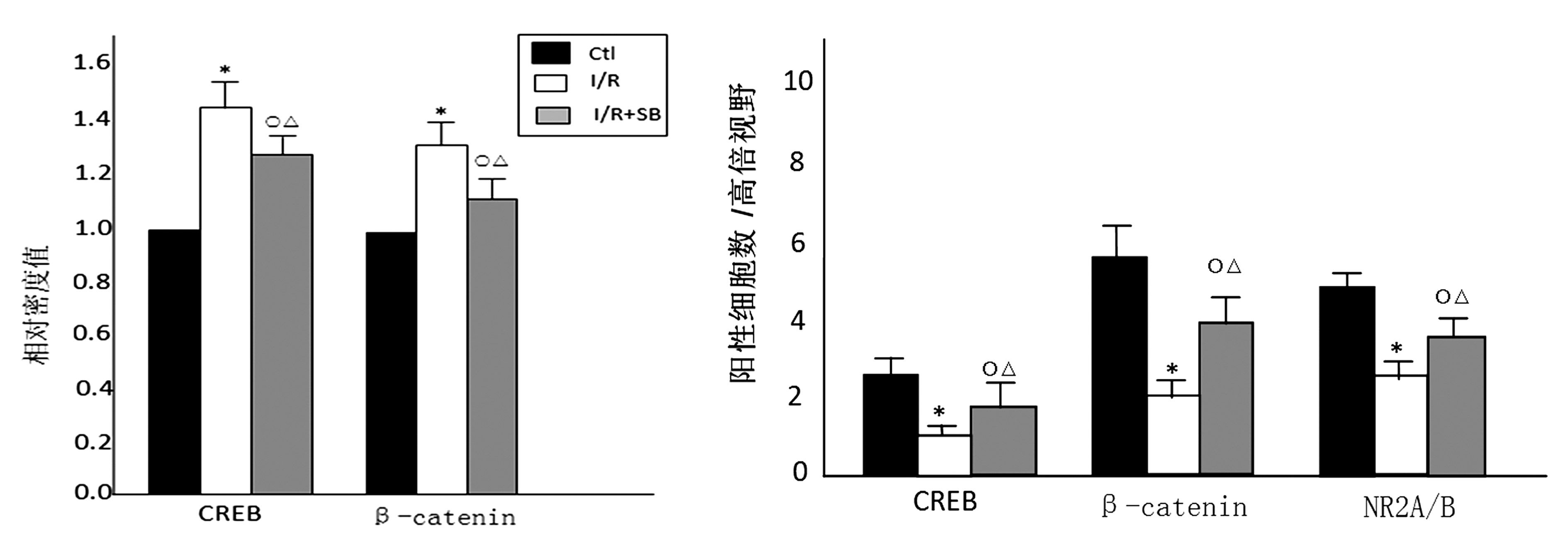
2.5 检测皮质和海马CREB、β-catenin的磷酸化水平 模型组皮质和海马CREB、β-catenin的磷酸化水平均显著高于空白对照组(P<0.01);SB组皮质和海马CREB、β-catenin的磷酸化水平低于模型组(P<0.05);SB组皮质和海马 CREB、β-catenin的磷酸化水平均高于空白对照组(P<0.05)。见图4。
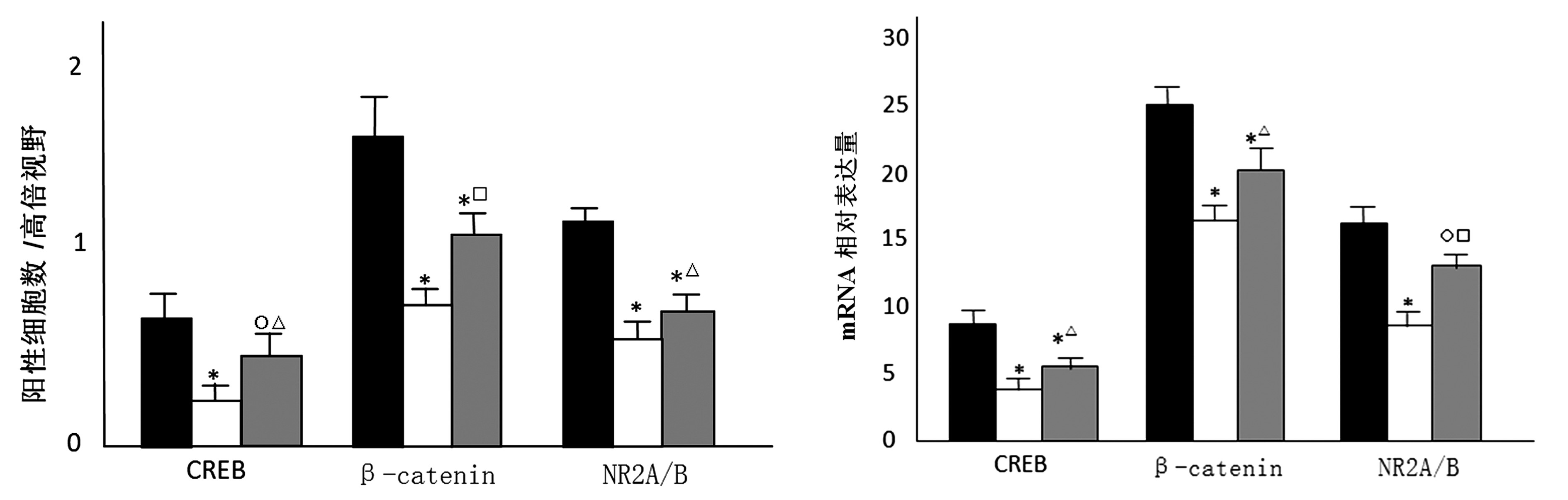
2.6 检测脑组织CREB、β-catenin及 NR2A/B的分布 免疫组化方法检测显示,海马每个视野中CREB、β-catenin及NR2A/B阳性细胞数显著多于皮层(P<0.01);在海马组织中,模型组每个视野中CREB、β-catenin及NR2A/B阳性细胞数显著少于空白对照组(P<0.01),SB组每个视野中CREB、β-catenin及NR2A/B阳性细胞数少于空白对照组(P<0.05),SB组每个视野中CREB、β-catenin及NR2A/B阳性细胞数多于模型组(P<0.05);在皮层中,模型组每个视野中CREB、β-catenin及NR2A/B阳性细胞数显著少于空白对照组(P<0.01),SB组每个视野中CREB阳性细胞数少于空白对照组(P<0.05),SB组每个视野中β-catenin 及NR2A/B阳性细胞数显著少于空白对照组(P<0.01),SB组每个视野中CREB及NR2A/B阳性细胞数多于模型组(P<0.05),SB组每个视野中β-catenin阳性细胞数显著多于模型组(P<0.01)。见图5~6。
2.7 检测皮质和海马CREB、β-catenin和NR2A/B的mRNA水平 SB组皮质和海马CREB、β-catenin高于模型组(P<0.05),NR2A/B的mRNA水平显著高于模型组(P<0.01)。见图7。
3 讨论
目前认为,脑缺血再灌注所导致的学习记忆功能障碍可能与脑组织因损伤而出现能量代谢异常、氧自由基释放、钙离子超载、兴奋性氨基酸过度释放及脑细胞组织凋亡等有关[7]。神经细胞对损伤性刺激特别敏感,尤其是缺血缺氧,而脑细胞缺血再灌注对致脑前区及海马组织等区域的神经细胞造成损伤,甚至是神经元细胞的凋亡、丢失,进而导致学习记忆功能的障碍[8-9]。
注:与空白对照组比较,*P<0.01,○P<0.05;与模型组比较,△P<0.05
图4 空白对照组、模型组、SB组皮质和海马 CREB、β-catenin的磷酸化水平比较结果比较 注:与空白对照组比较,*P<0.01,○P<0.05;与模型组比较,△P<0.05
图5 空白对照组、模型组、SB组海马 CREB、β-catenin及NR2A/B免疫组化结果比较
注:与空白对照组比较,*P<0.01,○P<0.05;与模型组比较,△P<0.05,□P<0.01
图6 空白对照组、模型组、SB组皮层CREB、β-catenin及NR2A/B免疫组化结果比较 注:与空白对照组比较,*P<0.01,○P<0.05;与模型组比较,△P<0.05,□P<0.01
图7 空白对照组、模型组、SB组皮质和海马CREB、β-catenin及NR2A/B的mRNA水平比较
GSK-3是一种广泛存在于真核细胞中的丝氨酸/苏氨酸激酶,具有将多种转录因子、信号蛋白及结构蛋白等进行磷酸化的作用,以此参与调节细胞的多种关键功能。GSK-3存在α、β两种异构体,后者具有高度的神经元特异性,对神经细胞的存活、凋亡及突触可塑性长时程增强形成等作用起到重要的调节功能。GSK3β的活性可通过不同磷酸化位点的状态进行调控,当GSK3β蛋白上第216位酪氨酸残基被磷酸化时,GSK3β处于激活状态,当第9位丝氨酸残基被磷酸化时,则处于失活状态[10]。GSK-3β活性的增加可促使神经细胞的凋亡、退行性改变,因而导致神经元功能的失调;反之,GSK-3β活性下降则促使神经元细胞的存活[11-15]。GSK-3β在海马组织中表达丰富,是对学习记忆功能起关键作用的信号分子。海马LTP形成是海马依赖的空间学习记忆的重要机制之一。研究表明,2VO术后大鼠学习记忆能力的下降与海马LTP的损伤和神经树突棘的密度减低均存在密切的关系[16]。当GSK-3β活性增加时,对LTP的形成起到抑制作用,诱导长时程抑制增加,阻碍海马记忆形成,引起学习记忆功能障碍;相反,GSK-3β活性下降时,可延缓脑缺血状态下引起的认知功能障碍加重[17-20]。CREB是细胞内重要的转录因子,在介导海马LTP形成起到重要作用,与记忆的形成与维持有密切关系,被认为是学习记忆分子[21-23]。当CREB活性上升时,可以提高脑损伤时脑细胞的存活率以及受损的认知功能,而当CREB的ser142位点磷酸化后活性降低,抑制海马LTP形成[24-26]。通过抑制GSK-3β的活性,可使CREB表达及活性增加[27-28]。而激活GSK-3β后,抑制CREB的活性,导致海马LTP形成障碍[29]。突触后膜上的N-甲基-D-天冬氨酸受体(NMDA-R)在海马LTP形成中同样起到关键作用,CREB介导的海马组织的LTP形成依赖于突触后膜上NMDA-R通道的开放[26]。NMDA-R与GSK-3β存在密切联系,GSK-3β激活可使NMDA-R亚型NR2A/B的表达受到抑制,导致LTP形成受阻[17]。而情绪学习记忆则与杏仁核中的β-catenin的表达有关,激活GSK-3β导致β-catenin的表达减少,磷酸化作用促使β-catenin的活性受到抑制,从而造成情绪学习记忆的功能障碍[17]。
本研究采用GSK-3β的特异性抑制SB216763(SB)对缺血再灌注大鼠模型的GSK-3β的活性进行抑制。经过水迷宫测试、电跳台测试可知,通过SB下调GSK-3β活性可使得缺血再灌注大鼠的空间学习记忆能力及情绪学习记忆能力明显增强,说明该模型大鼠的学习记忆障碍改善;采用电生理检测海马CA3区LTP形成发现,高频刺激后峰电位幅值和EPSP斜率均增大;进一步研究发现,下调GSK-3β活性后,CREB、β-catenin的磷酸化水平下降,CREB、β-catenin及NR2A/B的蛋白水平及mRNA水平均升高。而通过荧光定量测定证实,这3种物质在脑组织中正是主要存在于与学习记忆关系极为密切的海马组织,当缺血再灌注损伤后,海马组织中CREB、β-catenin及NR2A/B的分布随之下降。由此,我们认为,下调GSK-3β通过降低CREB、β-catenin的磷酸化水平下降,以提高大脑海马组织中CREB、β-catenin及NR2A/B的含量,从而使缺血再灌注模型大鼠的学习记忆功能得到改善。
本研究有望为研发防治脑缺血再灌损伤药物提供新的靶点和理论依据,具有重要的实际价值和指导意义。
4 参考文献
[1] NUNES H J,QUEIRS P J.Patient with stroke:hospital discharge planning,functionality and quality of life[J].Rev Esc Enferm Usp,2017,70(2):415.
[2] HATTORI K,LEE H,HURN P D,et al.Cognitive deficits after focal cerebral ischemia in mice[J].Stroke,2000,31(8):1 939-1 944.
[3] YANG Y.Cognitive Improvement Induced by Environment Enrichment in Chronic Cerebral Hypoperfusion Rats:a Result of Upregulated Endogenous Neuroprotection?[J].Mol Neurosci,2015,56(2):278-289.
[4] ZHAO Y,GONG C X.From chronic cerebral hypoperfusion to Alzheimer-like brain pathology and neurodegeneration[J].Cell Mol Neurobiol,2015,35(1):101-110.
[5] KELLY S,ZHAO H,SUN G H,et al.Glycogen syn-thase kinase 3beta inhibitor Chir025 reduces neuronal death resulting from oxygen-glucose deprivation,glutamate excitotoxicity,and cerebral ischemia[J].Exp Neurol,2004,188(2):378-386.
[6] COLLINO M,ARAGNO M S,TOMASINELLI C,et al.Insulin reduces cerebral ischemia/reperfusion injury in the hippocampus of diabetic rats:a role for glycogen synthase kinase-3beta[J].Diabetes,2009,58(1):235-242.
[7] HAGBERG H,LEHMANN A,SANDBERG M,et al.Ischemia-induced shift of inhibitory and ecitatory amin acids from intra to extracellular compartments[J].J Cere Blood Frow Metab,1990,10:646-649.
[8] DU G,ZHANG J T.Protective effects of salvianolic acid A against impairment of memoryinduced by cerebral ischemia-reperfusion in mice[J].Chin Med J (Engl),1997,110(1):65-68.
[9] LORRIO S,NEGREDO P,RODA J M,et al.Effects of memantine and galantamine given separately or in association,on memory and hippocampal neuronal loss after transient global cerebral ischemia in gerbils[J].Brain Res,2009,1 254:128-137.
[10] MAQBOOL M M,MOBASHIR M,HODA N.Pivotal role of glycogen synthase kinase-3:A therapeutic target for Alzheimer's disease[J].Eur Med Chem,2016,107:63-81.
[11] PAP M,COOPER G M.Role of Translation Initiation Factor 2B in Control of Cell Survival by the Phosphatidylinositol 3-Kinase/Akt/Glycogen Synthase Kinase 3_ Signaling Pathway[J].Mol Cell Biol,2002,22:578-586.
[12] AMEMORI T,JENDELOVA P,RUZICKA J,et al.Alzheimers disease:mechanism and approach to cell therapy[J].Int J Mol Sci,2015,16(11):26 417-26 451.
[13] SAATHOFF J M,CHOJNACKI J E,LIU K,et al.Design and evaluation of fluorescent probes to lucidate the mechanism of curcumin/ melatonin hybrids for Alzheimer's disease[J].Alzheimers Dement,2015,11(7):473.
[14] HUANG S W,WANG W,ZHANG M Y,et al.The effect of ethyl acetate extract from persimmon leaves on Alzheimefs disease and its underlying mechanism[J].Phytomedicine,2016,23(7):694-704.
[15] 郑桃林,王哲,刘超,等.淫羊藿苷对阿尔茨海默病细胞模型糖原合成酶激酶-3β表达的影响及机制[J].中国老年学杂志,2016,36(4):800-802.
[16] ZHENG C X,LU M,GUO Y B,et al.Electroacupuncture Ameliorates Learning and Memory and Improves Synaptic Plasticity via Activation of the PKA/CREB Signaling Pathway in Cerebral Hypoperfusion[J].Evid-Based Compl Al,2016,2016:7893710.
[17] GIESE K P.GSK-3:a key player in neurodegeneration and memory[J].Iubmb Life,2009,61(5):516.
[18] HOOPERr C,MARKEVICH V,PLATTNER F,et al.Glycogen synthase kinase-3 inhibition is integral to long-term potentiation[J].Eur J Neurosci,2007,25(1):81-86.
[19] CARACCI M O,VILA M E,DE FERRARI G V.Synaptic Wnt/GSK3β Signaling Hub in Autism[J].Neural Plast,2016,2016:9603751.
[20] 燕灏敏,杜雪蓓,章军建.当归对慢性脑低灌注大鼠阿尔茨海默病样变与认知功能的影响[J].中华老年心脑血管病杂志,2017,19(7):699-703.
[21] MAKELA J,TSELYKH T V,KUKKONEN J P,et al.Peroxisome proliferator-activated receptor-γ/(PPARγ)agonist is neuroprotective and stimulates PGC-1α expression and CREB phosphorylation in human dopaminergic neurons[J].Neuropharmacology,2016,102:266-275.
[22] YIN Y,GAO D,WANG Y,et al.Tau accumulation induces synaptic impairment and memory deficit by calcineurin-mediated inactivation of nuclear CaMKIV/CREB signaling[J].P Natl Acad Sci Usa,2016,113(26):E3773.
[23] JING Z,CAI C Y,WU H Y,et al.Corrigendum:CREB-mediated synaptogenesis and neurogenesis is crucial for the role of 5-HT1a receptors in modulating anxiety behaviors[J].Sci Rep,2016,6:29 551.
[24] HU S,CAO Q,XU P,et al.Rolipram stimulates angiogenesis and attenuates neuronal apoptosis through the cAMP/cAMP responsive element binding protein pathway following ischemic stroke in rats[J].Exp Ther Med,2016,11(3):1 005-1 010.
[25] LIU B B,LUO L,LIU X L,et al.Essential oil of Syzygium aromaticum reverses the deficits of stress-induced behaviors and hippocampal p-ERK/p-CREB/brain-derived neurotrophic factor expression[J].Planta Med,2015,81(3):185.
[26] GONG B,VITOLO O V,TRINCHESE F,et al.Persistent improvement in synaptic and cognitive functions in an Alzheimer mouse model after rolipram treatment[J].J Clin Invest,2004,114(11):1 624.
[27] LIU G P.Glycogen synthase kinase-3beta regulates tyrosine-307 phosphorylation of protein phosphatase-2A via protein tyrosine phosphatase 1B but not Src[J].Biochem J,2011,7(4):335-344.
[28] WOODGETT J R,OHASHI P S.GSK3:an in-Toll-erant protein kinase?[J].Nat Immunol,2005,6(8):751.
[29] TULLAI J W,CHEN J,SCHAFFER M E,et al.GSK-3 represses CREB-targeted immediate early genes in quiescent cells[J].J Biol Chem,2007,282(13):9 482-9 491.
(收稿2018-01-23 修回2018-02-20)
本文编辑:夏保军
本文引用信息:王毅华,陈真珍,谭文澜,曾振,姚秀卿,王凯华.下调糖原合酶激酶3β活性改善脑缺血再灌注大鼠学习记忆障碍的机制研究[J].中国实用神经疾病杂志,2018,21(6):581-587.