目的 通过观察三七总皂苷(PNS)对脑损伤大鼠损伤区血管内皮生长因子(Vscular Endothelial Growth Factor,VEGF) 以及碱性成纤维生长因子(Fibroblastic Growth Factors,FGF)表达的影响,探讨三七总皂甙(PNS) 对脑损伤大鼠发挥脑保护作用可能的相关机制。方法 采用自由落体法建立大脑急性损伤大鼠模型,随机将60只健康雄性 Wistar大鼠分为假手术组、对照组和PNS治疗组。应用神经行为学评分评价大鼠神经功能症状,Western blot法检
三七总皂苷对脑损伤模型大鼠神经行为学 损伤区VEGF及FGF表达影响的研究
张令春1) 褚延乐2) 王梦妮3)
1)河南省人民医院临床药学科,河南 郑州 450003 2)郑州大学第二附属医院药学部,河南 郑州 450014 3)郑州大学药学院,河南 郑州 450001
基金项目:常州四药临床药学科研基金(CZSYJJ16023)
作者简介:张令春(1979-),女,主管药师,硕士。研究方向:主要从事临床药学研究。Email: yueding200631@126.com
【摘要】 目的 通过观察三七总皂苷(PNS)对脑损伤大鼠损伤区血管内皮生长因子(Vscular Endothelial Growth Factor,VEGF) 以及碱性成纤维生长因子(Fibroblastic Growth Factors,FGF)表达的影响,探讨三七总皂甙(PNS) 对脑损伤大鼠发挥脑保护作用可能的相关机制。方法 采用自由落体法建立大脑急性损伤大鼠模型,随机将60只健康雄性 Wistar大鼠分为假手术组、对照组和PNS治疗组。应用神经行为学评分评价大鼠神经功能症状,Western blot法检测大鼠损伤区VEGF及FGF的阳性表达情况。结果 对照组与PNS治疗组比较脑损伤大鼠的神经功能评分显著提高(P<0.01);PNS治疗组VEGF及FGF蛋白阳性表达较假手术组和对照组均明显增高(均 P<0.001) 。结论 PNS的治疗干预可以使急性脑损伤模型大鼠的行为学症状得到明显改善,其机制可能是通过促进急性脑损伤大鼠脑组织VEGF及FGF表达,抑制神经细胞凋亡,发挥神经保护作用。
【关键词】 大鼠;脑损伤;血管内皮生长因子;三七总皂苷;碱性成纤维生长因子;神经行为学;炎症;继发性损伤
【中图分类号】 R-332 【文献标识码】 A 【文章编号】 1673-5110(2018)07-0697-05 DOI:10.12083/SYSJ.2018.07.176
Effects of the Panax Notoginsen Saponins on expression of vscular endothelial growth factor and fibroblastic growth factors in rats with traumatic brain injury
ZHANG Lingchun1),CHU Yanle2),WANG Mengni3)
1)The People's Hospital of Henan,Zhengzhou 450003,China;2)Department of Pharmaceutical,the Second Affiliated Hospital of Zhengzhou University,Zhengzhou 450014,China;3) Pharmacy college,Zhengzhou University,Zhengzhou 450001,China
【Abstract】 Objective To observe the effects of the Panax Notoginseng Saponins (PNS) on the expression of vascular endothelial growth factor(VEGF) and fibroblastic growth factors (FGF)in rats with traumatic brain injury,and to explore the possible mechanism of the protective effect of the PNS on traumatic brain injury rats.Methods A rat model of traumatic brain injury by using the weight-drop injury method was established.60 healthy male Wistar rats were randomly divided into three groups:sham operation group,model group and PNS treatment group.The positive expression of VEGF and FGF in the traumatic brain injury of rats was detected by using the western blot.Results The neurological function score of model group was significantly improved compared to the PNS treatment group (P<0.01);the expression of VEGF and FGF in PNS group were significantly higher than that in sham operation group and model group(P<0.001).Conclusion The therapeutic intervention of PNS can improve the behavior of the model rats.The mechanism may be to inhibition of the apoptosis of nerve cells and improving the expression of VEGF and FGF in brain.
【Key words】 Rats;Traumatic Brain Injury;Vscular Endothelial Growth Factor;Panax Notoginseng Saponins;Fibroblastic Growth Factors;Neuroethology;Inflammation;Secondary lesion
急性颅脑损伤(traumatic brain injury,TBI)是脑外科最常见的疾病之一。近些年来由于经济的飞速发展导致建筑意外、交通事故以及跌打损伤等引起的颅脑损伤也日渐增多。颅脑损伤患者的病死率极高,即使存活下来,也会给幸存者带来不同程度的残疾和心理问题[1],这些问题会直接或影响其工作和社会行为,给患者的生活质量造成严重威胁,同时对这类患者的康复治疗照顾也会给社会带来沉重负担。因此,创伤性颅脑损伤救治的重大课题就是改善患者的生存质量,降低残疾和病死率。患者在受到创伤性颅脑损伤后会发生一系列复杂的生理病理变化[2-4],除了暴力造成的急性的神经元及胶质细胞的直接损伤、血管破坏等机械性损伤以外,还包含由于微环境改变而导致的细胞因子改变从而触发的级联反应所引发的继发性损伤(包括缺血、缺氧、自由基损伤、离子失衡、炎症反应和细胞凋亡等),这两种损伤结合引起 TBI患者脑微循环变化,引起患者脑细胞的生理功能的异常变化。因此,防止微循环障碍、促进损伤区微循环修复,是常用的治疗手段。但是,临床上传统的扩容及使用自由基清除剂、Ca+拮抗剂等治疗方法则效果欠佳。
三七在我国常常被用于治疗缺血性脑卒中,它具有消痛散瘀的作用。中药三七中最主要的化学成分是三七总皂苷(panax notoginseng saponins,PHS),其主要作用是增加脑血流量,降低血黏度,抑制血小板聚集从而改善微循环[5]。因此,近年来三七总皂苷被广泛用于治疗心脑血管疾病。有研究表明,颅脑损伤后,应用三七总皂苷能够缓解脑水肿,改善血脑屏障的通透性,从而起到脑保护作用[6]。但是,目前对PNS治疗创伤性颅脑损伤的作用机制还不是特别清楚。本研究所采用大鼠创伤性颅脑损伤模型由自由落体法实现,采用PNS对模型进行干预,采用神经行为学评分对治疗结果进行评价,Western blot法检测大鼠海马区不同时间点的促血管生成因子VEGF及FGF表达的变化,探讨PNS修复创伤性颅脑损伤的作用机制。
1 材料与方法
1.1 材料 购买自河南省实验动物中心SPF级成年雌性Wistar大鼠60只,体质量为(200±5)g;注射用血塞通冻干针剂(PNS,规格:120 mg;昆明制药集团股份有限公司);FGF抗体、VEGF抗体(Santa Cruz)。
1.2 方法
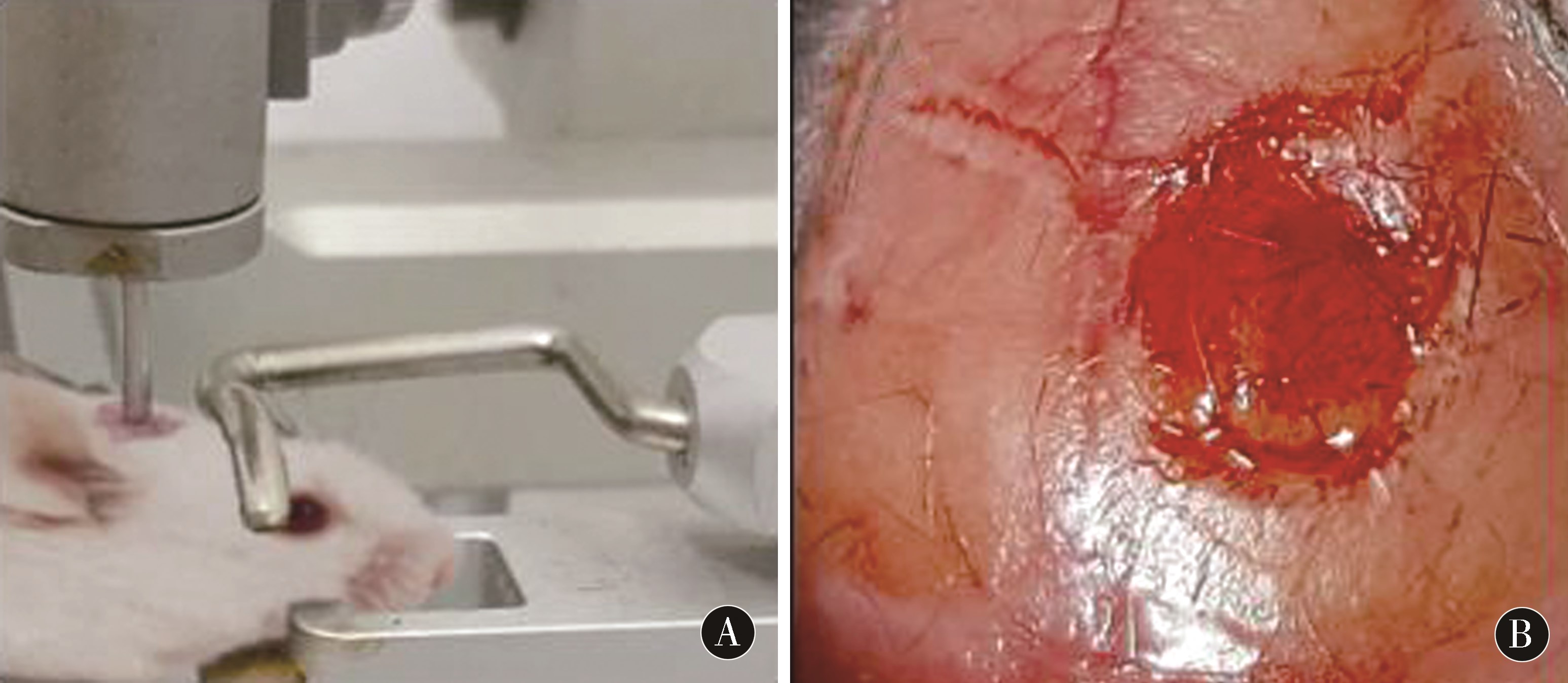
1.2.1 TBI损伤模型制作:大鼠中度创伤性颅脑损伤模型采用 Feeney 自由落体硬膜外撞击法建立[7]。具体操作方法:采用10%水合氯醛对各组大鼠行腹腔注射(2 mL/kg)麻醉,头部备皮后将其固定于脑立体定向仪上,常规消毒和铺巾后,沿中线切开大鼠的头顶部皮肤,采用钝性分离对皮下组织进行分离,切开骨膜之后分离,并用牙科磨钻出骨窗,值得注意的是在操作过程中要尽量保证硬脑膜的完整性。具体操作方法:把撞击圆锥头端置于骨窗上,将砝码从距离骨窗35 cm的高处自由垂直落下,使之撞击硬膜上的圆锥,以形成中度脑损伤[8]。建模之后清理创伤面、止血,应用骨蜡将骨窗封闭,缝合。术后腹腔注射注射左氧氟沙星。对照组和治疗组在模型制作完毕后经腹腔分别注射 100 mg/mL生理盐水和此前制备好的PNS溶液100 mg/mL。在注射过程中,要密切注意大鼠的生理变化,术后需要单笼饲养。若实验过程中因操作和其他并发症引起死亡时,则去除该大鼠的所有实验数据,同时要注意补充新的大鼠,并记录其实验数据。将60只Wistar大鼠随机分为假手术组(切开头部皮肤,颅骨钻孔后不损伤脑组织不治疗),治疗对照组(制作中度创伤性颅脑损伤模型成功后行腹腔注射生理盐水)及PNS治疗组(制作中度创伤性颅脑损伤模型成功后行腹腔注射PNS,剂量100 mg/kg)。见图1。
图1 动物模型制作:A大鼠脑损伤模型制作;B大鼠中度创伤性损伤后
1.2.2 神经行为学评分:大鼠麻醉苏醒后,单笼饲养,分别于损伤后的第3天和第7天的固定时间点从每组中取出10只大鼠,大鼠的神经运动感觉功能的系统评估主要采用改良的神经损伤程度评分量表(modified neurological severity scores,mNSS)来进行评估[9-11]。评分采用双盲法,具体操作方法:由熟知mNSS评分的2名不知情的实验员对各组大鼠的运动、感觉、平衡以及反射进行测试,并详细记录数据。评分表总分为0~18分,重度损伤为13~18,中度损伤为7~12分,轻度损伤为1~6分,正常大鼠的评分为0分。大鼠的神经功能采用运动、感觉、平衡4个方面来评价。
1.2.3 western blot检测:不同时间点损伤处组织VEGF及FGF表达变化,术后7 d将大鼠麻醉后固定于手术台上,无菌条件下分离脑组织,以损伤处为中心,截取大鼠脑组织约2 mm3,用预冷的生理盐水冲洗数次后置于冻存管中并快速存放于液氮中备用。RAPI裂解组织后12 000 r/min 4 ℃离心10 min,取上清,BCA法测量蛋白浓度,后经聚丙烯酰胺凝胶电泳。转膜1.5 h,后置于50 g/L的脱脂奶粉溶液中室温封闭1 h,VEGF一抗(1:1 000稀释)、FGF一抗(1:800稀释)过夜孵育,用TBST溶液洗膜3次后于辣根过氧化物酶标记的山羊抗鼠二抗溶液中室温下孵育2 h,TBST溶液洗膜3次,显影成像,最后用Image J软件进行蛋白灰度分析。
1.3 统计学处理 采用SPSS 19.0软件进行数据处理。采用重复测量数据的方差分析比较各组大鼠mNSS评分以及VEGF及FGF蛋白表达的差异,检验水准α=0.05。
2 结果
2.1 大鼠神经损伤程度评分结果 在模型大鼠进行治疗后的第3天特定时间点对各组大鼠进行 mNSS评分,结果显示,在PNS治疗后3 d内各手术组间差异不显著,且假手术组大鼠行为学表现正常;在治疗后第7天的同一时间点对各组大鼠进行 mNSS评分,对照组的评分则高于治疗组,差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠 mNSS 评分比较 (x±s,分)
| 组别 |
n |
3 d |
7 d |
| 假手术组 |
10 |
0 |
0 |
| 对照组 |
10 |
11.14±0.93 |
10.93±0.46 |
| 治疗组 |
10 |
10.25±1.32 |
7.98±1.05 |
| P值 |
|
>0.05 |
<0.05 |
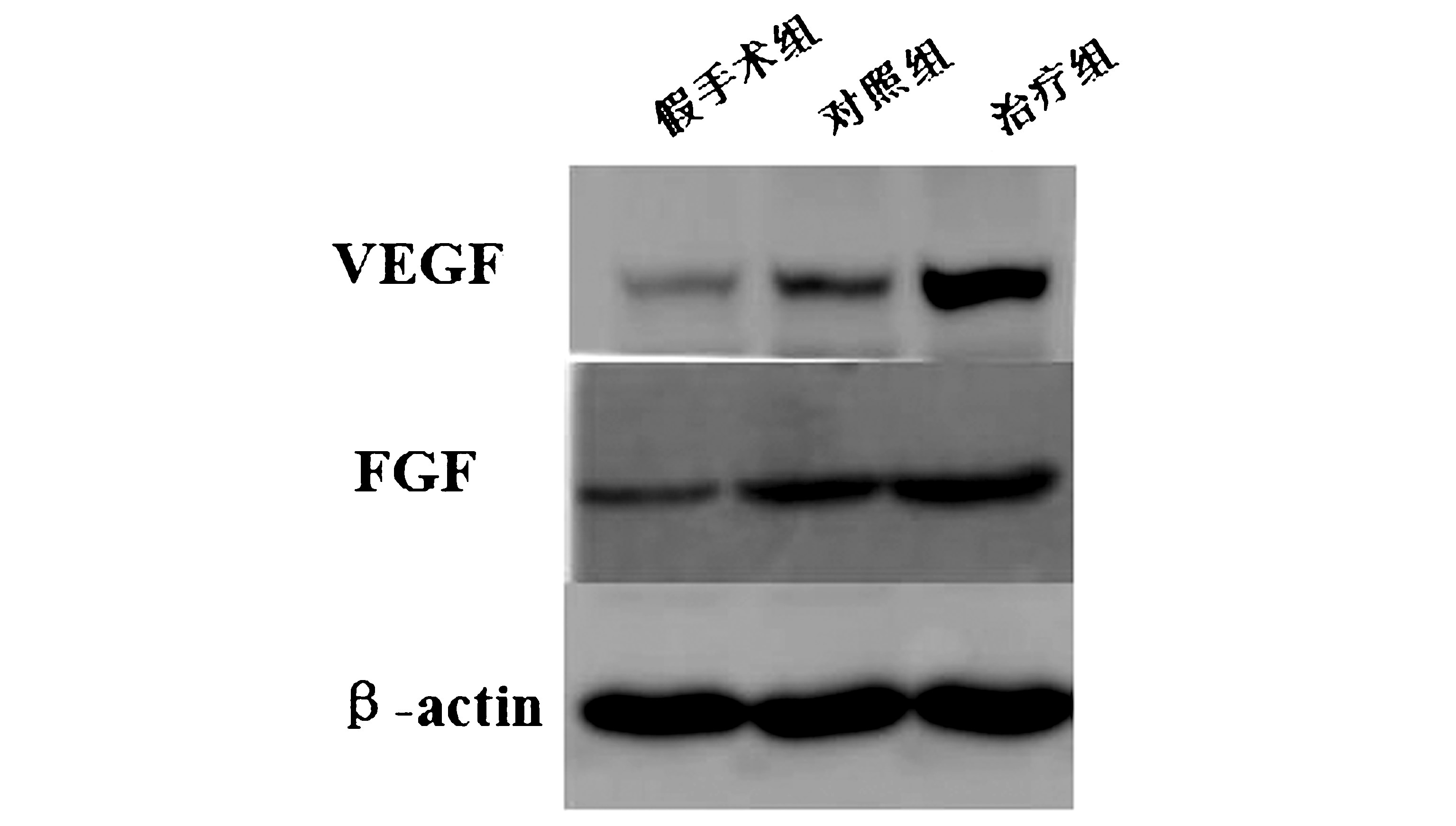
2.2 损伤组织中VEGF及FGF表达变化 Western blot结果显示,术后7 d时对照组与治疗组中VEGF蛋白及FGF蛋白的表达均高于假手术组,与对照组相比较治疗组中VEGF的表达明显升高(P<0.05)。见图2、表2。
图2 SCI后28 d 各组大鼠脊髓组织蛋白表达比较
表2 TBI 7 d后VEGF、FGF蛋白在各组大鼠脑组织中的表达变化 (x±s)
| 组别 |
n |
VEGF蛋白表达 |
FGF蛋白表达 |
| 假手术组 |
3 |
1.00±0.06 |
1.05±0.06 |
| 对照组 |
3 |
0.97±0.05* |
1.74±0.14 |
| 治疗组 |
3 |
1.54±0.08*# |
2.09±0.15 |
| F值 |
|
49.527 |
49.625 |
| P值 |
|
<0.001 |
<0.001 |
注:与假手术组相比,*P<0.05;与对照组相比,#P<0.05
3 讨论
三七总皂苷是三七中的有效活性成分,具有活血化瘀,消肿止痛的功效。实验研究表明,三七皂苷能够保护心脑血管缺血缺氧损伤,且能够抑制脑神经细胞的凋亡[12-15]。
随着经济的高速发展,车祸和建筑意外导致的脑损伤数量不断增加[16-17]。由于引起脑损伤的创伤包含机械损伤外,还有继发性的脑损伤,二者都会引起脑损伤患者脑部微循环的变化。损伤的血管内皮细胞及其形态的变化可引起患者血管管壁组织结构的变化,进而导致局部血液流变出现变化,引起微循环障碍[18-20],微循环障碍是局部微环境损伤的重要病理生理基础,也是影响患者神经恢复的重要因素。
VEGF在脑组织内有比较丰富的表达,还是生成血管的关键调节因子,特异地作用于血管内皮细胞,改善和帮助恢复损伤脑组织的血液供应,是效果最好的促血管生长因子之一。VEGF有强大的促进新生血管形成的能力,且能有效促进伤口的愈合[21-22]。VEGF也是目前挽救和治疗缺血性脑血管疾病和缺血半暗区脑组织功能损伤的关键所在。近些年对VEGF与中枢神经系统的诸如阿尔兹海默、帕金森等其他疾病之间的关系的研究也越来越多[23-24],这足以看出VEGF具有巨大的应用前景。已有研究表明,PNS能够降低大鼠血小板聚集率,延长其颈总动脉血栓形成的时间,具有抗血栓作用[25]。本研究从神经行为学上证实,模型组大鼠经PNS治疗后神经行为获得较为明显的改善,为PNS向临床应用提供了一定的依据。治疗组大鼠颅脑损伤区域VEGF蛋白表达明显高于假手术组和对照组(P<0.001),该研究表明PNS在一定程度上能够促进大鼠损伤脑区域的VEGF的表达。
FGF有促进新生血管形成、提高脑组织超氧化物歧化酶(SOD)活性、增加脑血流量、抑制一氧化氮(NO)产生等功能,因此能够促进脑损伤患者的恢复[26-28]。本实验表明,PNS 治疗组大鼠损伤区FGF蛋白表达也明显高于假手术组和对照组(P<0.001),说明PNS 能够促进大鼠损伤脑组织中FGF的表达。
综上,PNS可以增加颅脑损伤大鼠脑损伤区域VEGF及FGF的表达量。该研究不仅为PNS治疗颅脑损伤提供了科学的实验依据,也开拓了临床治疗颅脑损伤的新思路,也为以后进一步研究VEGF和FGF的脑保护机制提供了线索。
4 参考文献
[1] EDAVETTAL M,GROSS B W,RITTENHOUSE K,et al.An Analysis of Beta-Blocker Administration Pre-and Post-Traumatic Brain Injury with Subanalyses for Head InjurySeverity and MyocardialInjury[J].Am Surg,2016,82(12):1 203-1 208.
[2] KUROWSKI B G,TREBLE-BARNA A,PITZER A J,et al.Applying Systems Biology Methodology To Ident-ify Genetic Factors Possibly Associated with Recovery after Traumatic Brain Injury[J].J Neurotra,2017,34(14):2 280-2 290.
[3] PILIPOVIC K,UPAN,DOLENEC P,et al.A single dose of PPARγ agonist pioglitazone reduces cortical oxidative damage and microglial reaction following lateral fluid percussion brain injury in rats[J].Prog Neuropsy Biol Psych,2015,59:8-20.
[4] XU X,GAO W,CHENG S,et al.Anti-inflammatory and immunomodulatory mechanisms of atorvastatin in a murine model of traumatic brain injury[J].Neuroinflam,2017,14(1):167.
[5] 吴兰鸥,詹合琴,闫峻岭,等.三七皂苷Rg1对大鼠脑缺血_再灌注损伤的保护作用及机制探讨[J].中草药,2006,37(2):229-233
[6] 韩金安,匡永勤,周虎田,等.三七总皂甙对家兔脑损伤后脑组织中丙二醛含量变化的影响[J].中国病理生理杂志,2000,16(3):269-271.
[7] FEENEY D M,BOYESON M G,LINN R T,et al.Responses to cortical injury:Methodology and local effects of contusions in the rat[J].Brain Res,1981,211(1):67-77.
[8] LI D,MA S,GUO D,et al.Environmental Circadian Disruption Worsens Neurologic Impairment and Inhibits Hippocampal Neurogenesis in Adult Rats After Traumatic Brain Injury[J].Cell Mol Neurobiol,2016,36(7):1 045-1 055.
[9] HONMA T,HONMOU O,IIHOSHI S,et al.Intrav-enous infusion of immortalized human mesenchymal stem cells protects against injury in a cerebral ischemia model in adult rat[J].Exp Neurol,2006,199(1):56-66.
[10] CHEN X,WU S,CHEN C,et al.Omega-3 polyunsaturated fatty acid supplementation attenuates microglial-induced inflammation by inhibiting the HMGB1/TLR4/NF-κB pathway following experimental trauma-tic brain injury[J].Neuroinflam,2017,14(1):143.
[11] ZHANG L,YI L,CHOPP M,et al.Intravenous administration of human umbilical tissue-derived cells improves neurological function in aged rats after embolic stroke[J].Cell Transplant,2013,22(9):1 569-1 576.
[12] 李韬,曲德英,雷菠,等.三七粉对家兔实验性动脉粥样硬化的影响[J].中医研究,2006,19(1):17-19.
[13] 孙小梅,姚琰,纪三姣,等.三七总皂甙对冠心病病人血浆内颗粒膜蛋白和血小板聚集的影响[J].数理医药杂志,2001,14(1):26-27.
[14] LI H,DENG C Q,CHEN B,et al.Total saponins of Panax notoginseng modulate the expression of caspases and attenuate apoptosis in rats following focal cerebral ischemia-reperfusion[J].Ethnopharmaco,2009,121(3):412-418.
[15] ZHENG M,QU L,LOU Y.Effects of icariin combined with Panax notoginseng saponins on ischemia reperfusion-induced cognitive impairments related with oxida-tive stress and CA1 of hippocampal neurons in rat[J].Phytother Res,2008,22(5)):597-604.
[16] LEE H F,LEE T S,KOU Y R.Anti-inflammatory and neuroprotective effects of triptolide on traumatic brain injury in rats[J].Respir Physiol Neurobiol,2012,182(1):1-8.
[17] 张文进.人脐带沃顿胶间充质干细胞移植治疗对大鼠脑损伤区微循环的影响[D].郑州大学,2014.
[18] TAO X G,SHI J H,HAO S Y,et al.Protective Effects of Calpain Inhibition onNeurovascular Unit Injury through Downregulating Nuclear Factor-κB-related Inflammation during Traumatic Brain Injury in Mice[J].Chin Med J (Engl),2017,130(2):187-198.
[19] HOU S T,JIANG S X,ZAHARIA L I,et al.Phaseic Acid,an Endogenous and Reversible Inhibitor of Glutamate Receptors in Mouse Brain[J].Biol Chem,2016,291(53):27 007-27 022.
[20] CHODOBSKI A,CHUNG I,KONIEWSKA E,et al.Early neutrophilic expression of vascular endothelial growth factor after traumatic brain injury[J].Neurosci,2003,122(4):853-867.
[21] WANG L,WANG J,WANG F,et al.VEGF-Mediated Cognitive and Synaptic Improvement in Chronic Cerebral Hypoperfusion Rats Involves Autophagy Process[J].Neuromolecular Med,2017,19(2/3):423-435.
[22] REESON P,TENANT K A,GERROW K,et al.Delay-ed inhibition of VEGF signaling after stroke attenuates blood-brain barrier breakdown and improves functional recovery in a comorbidity-dependent manner[J].Neurosci,2015,35(13):5 128-5 143.
[23] SKLADNEV N V,GANESHAN V,KIM J Y,et al.Widespreadbrain transcriptome alterations underlie the neuroprotective actions of dietary saffron[J].Neurochem,2016,139 (5):858-871.
[24] EIBEL B,MELISSA M,CLARISSA G,et al.VEGF gene therapy cooperatively recruits molecules from the immune system and stimulates cell homing and angiogenesis in refractory angina[J].Cytokine,2017,91(Supplement C):44-50.
[25] 孙晓庆,赵明,刘兆平,等.三七总皂苷对大鼠脑缺血再灌注损伤保护研究[J].内蒙古中医药,2010,9(18):40-41.
[26] PEDERSEN M ,LARSEN A,PEDERSEN D S.Metallic gold treatment reduces proliferation of inflammatory cells,increases expression of VEGF and FGF,and stimulates cell proliferation in the subventricular zone following experimental traumatic brain injury[J].Histol Histopathol,2009,24(5):573-586.
[27] WOODBURY M E,IKEZU T.Fibroblast Growth Factor-2 Signaling in Neurogenesis and Neurodegeneration[J].J Neuroim Pharmacol,2014,9(2):92-101.
[28] CLARKE W E,BBERRY M,SMITH C,et al.Coordination of Fibroblast Growth Factor Receptor 1 (FGFR1) and Fibroblast Growth Factor-2 (FGF-2) Trafficking to Nuclei of Reactive Astrocytes around Cerebral Lesions in Adult Rats[J].Mol Cell Neurosci,2001,17(1):17-30.
(收稿2017-09-24 修回2018-03-08)
本文编辑:张喜民
本文引用信息:张令春.三七总皂苷对脑损伤模型大鼠神经行为学 损伤区VEGF及FGF表达影响的研究[J].中国实用神经疾病杂志,2018,21(7):697-701.