目的 观察银杏二萜内酯葡胺注射液对大鼠脑缺血/再灌注损伤的保护机制。方法 参照Longa法制备大鼠局灶性脑缺血再灌注动物模型。实验大鼠随机分为假手术组、模型组、银杏二萜内酯葡胺组。在脑缺血/再灌注24 h进行行为学评分,检测大鼠脑组织中超氧化物歧化酶(SOD)、谷胱甘肽(GSH)和丙二醛(MDA)活性的变化,并检测脑组织病理变化(HE染色),用Western blot检测NF-κB的表达结果。结果 与对照组相比,银杏二萜内酯葡胺组大鼠的神经行为学评分显著提高,MDA含量降低,GSH及SOD的活性明显
银杏二萜内酯葡胺注射液对大鼠脑缺血/再灌注神经保护作用的研究
刘新生 王 昆 李时光 李艾帆 张瑞锋
郑州市第一人民医院 神经内科,河南 郑州 450004
基金项目:河南省科技攻关计划项目(编号:132102310388);郑州市科技发展计划项目(编号:2015005)
作者简介:刘新生,Email:lxsneuro@163.com
【摘要】 目的 观察银杏二萜内酯葡胺注射液对大鼠脑缺血/再灌注损伤的保护机制。方法 参照Longa法制备大鼠局灶性脑缺血再灌注动物模型。实验大鼠随机分为假手术组、模型组、银杏二萜内酯葡胺组。在脑缺血/再灌注24 h进行行为学评分,检测大鼠脑组织中超氧化物歧化酶(SOD)、谷胱甘肽(GSH)和丙二醛(MDA)活性的变化,并检测脑组织病理变化(HE染色),用Western blot检测NF-κB的表达结果。结果 与对照组相比,银杏二萜内酯葡胺组大鼠的神经行为学评分显著提高,MDA含量降低,GSH及SOD的活性明显升高,NF-κB表达下调,脑组织病理改变减轻。结论 银杏二萜内酯葡胺注射液可能通过抑制氧化损伤和炎症反应对大鼠脑缺血/再灌注损伤发挥保护作用。
【关键词】 银杏二萜内酯葡胺;脑缺血;再灌注;神经保护;氧化损伤
【中图分类号】 R-332 【文献标识码】 A 【文章编号】 1673-5110(2018)21-2321-05 DOI:10.12083/SYSJ.2018.21.499
Protective effects of Ginkgo Terpene Lactones on focal cerebral ischemia/reperfusion injure in rats
LIU Xinsheng,WANG Kun,LI Shiguang,LI Aifan,ZHANG Ruifeng
Department of neurology,The First Hospital of Zhengzhou,ZhengZhou 450004,China
【Abstract】 Objective To investigate the protective effects of Ginkgo Terpene Lactones injection on focal cerebral ischemia/reperfusion injure in rats.Methods Middle cerebral artery occlusion was prepared as reporteded by Longa.Rats were randomly divided into sham group,model group,Ginkgo Terpene Lactones group.After 24h cerebral ischemia/reperfusion,behavioral scores were evaluated.HE staining was used to detect the pathological changes in brain tissue.The levels of SOD,GSH and MDA in brain tissue were also determined.The expressions of NF-κB were measured by Western blot.Results Compared with model group,Ginkgo Terpene Lactones could improve the rats’neural behavior scores and reduce pathological changes area.Meanwhile,the activity of SOD and GSH were increased,while the content of MDA was decreased.It also reduced the expression of NF-κB.Conclusion Ginkgo Terpene Lactones injection has protective effects of on focal cerebral ischemia/reperfusion injure in rats,which possibly through inhibition of oxidative damage and inflammation.
【Key words】 Ginkgo Terpene Lactones;cerebral ischemia;reperfusion;neuroprotection;oxidative damage
脑缺血/再灌注时会出现氧自由基释放过度、炎症反应等,导致神经元损伤[1-2]。当氧自由基的产生远超过机体自身清除能力时,破坏细胞膜,损伤血管及神经元及胶质细胞等,导致神经功能损害。本实验通过对脑缺血/再灌注损伤的大鼠模型进行研究,初步探讨银杏二萜内酯葡胺注射液对脑缺血/再灌注损伤的保护作用及机制。
1 材料与方法
1.1 实验动物与试剂 SD大鼠(SPF级),雄性,体质量220~260 g,5月龄,由河南省动物实验中心提供。饲养大鼠于屏障环境中,相对湿度50%~60%,温度23~25 ℃,自由进食水,5 d后开始实验。超氧化物歧化酶(SOD)、谷胱甘肽(GSH)和丙二醛(MDA)放免试剂盒购自碧云天生物技术研究所,其他试剂均为市售分析纯。银杏二萜内酯葡胺注射液(江苏康缘药业股份有限公司,批号140204)。
1.2 仪器 高速台式低温离心机(德国Heraeus),恒温振荡器(常州国华公司ZD-85),电子分析天平(湘医天平制造厂AEU-210)。
1.3 方法
1.3.1 动物分组及模型制备:实验动物随机分成3组:模型组、假手术组、银杏二萜内酯葡胺组,每组12只。所有动物手术前1 d禁食水。实验组大鼠注射相应浓度的药物(经尾静脉),模型组和假手术组用生理盐水代替。
本实验采用Longa法[3]制备缺血性卒中大鼠模型。腹腔注射10%水合氯醛(320 mg/kg)麻醉大鼠,仰卧固定,颈部正中切开,依次分离皮下组织及肌肉,充分暴露切口处血管及神经组织,游离颈部血管丛,处理颈外动脉,在颈总动脉作一切口,插入线栓,缓慢推进至大脑中动脉(约16 mm),造成血管闭塞,后固定线栓,结扎,缝合,脑缺血模型形成;2 h后缓慢拔出线栓,实现大鼠缺血模型再灌注。假手术组只插入线栓、不阻断大脑中动脉。
1.3.2 大鼠行为学评分:造模后12 h、24 h、48 h、72 h,提鼠尾悬空,观察前肢活动;置于地面,观察其行走情况,后推双肩,观察两侧抵抗力的差异。分数越高,说明其神经行为损伤越严重。见表1。
1.3.3 SOD、GSH和MDA含量测定:随机取大鼠每组4只,断头,取适量脑组织加生理盐水制成1%的匀浆液,离心(3 400 r/min) 9~10 min,取上清,用BCA蛋白试剂盒测蛋白浓度(按照试剂盒说明书进行)。
1.3.4 组织学分析:随机取大鼠每组6只,断头、取脑,10%中性福尔马林液固定,按常规石蜡切片技术处理,切片后HE染色,光学显微镜下观察组织结构。
1.3.5 大鼠NF-κB含量测定:随机取各组大鼠适量脑组织,裂解成匀浆液,使用western blot方法测定NF-κB的含量。
1.4 实验数据处理 应用SPSS 20.0处理数据,实验数据用均数±标准差(x±s)表示,组间用单因素方差分析进行比较。
2 结果
2.1 实验大鼠神经行为学影响 模型组动物提尾悬空时出现左前肢内收等局灶性神经行为损害症状。术后48 h、72 h评分:银杏二萜内酯葡胺组与模型组相比,行为评分有显著性差异(P<0.01)。提示银杏二萜内酯葡胺注射液可改善脑缺血/再灌注模型大鼠的行为活动能力。见表2。
2.2 各组动物生化测定结果 与假手术组比较,模型组动物较GSH及SOD含量显著降低,MDA含量增加,提示缺血/再灌注损伤可至脑组织内GSH、SOD以及MDA的含量发生统计学意义上的变化;与模型组相比,银杏二萜内酯葡胺组SOD、GSH明显提高,MDA明显减少,提示该药物可减轻脑组织中GSH、SOD以及MDA等物质的改变。见表3。
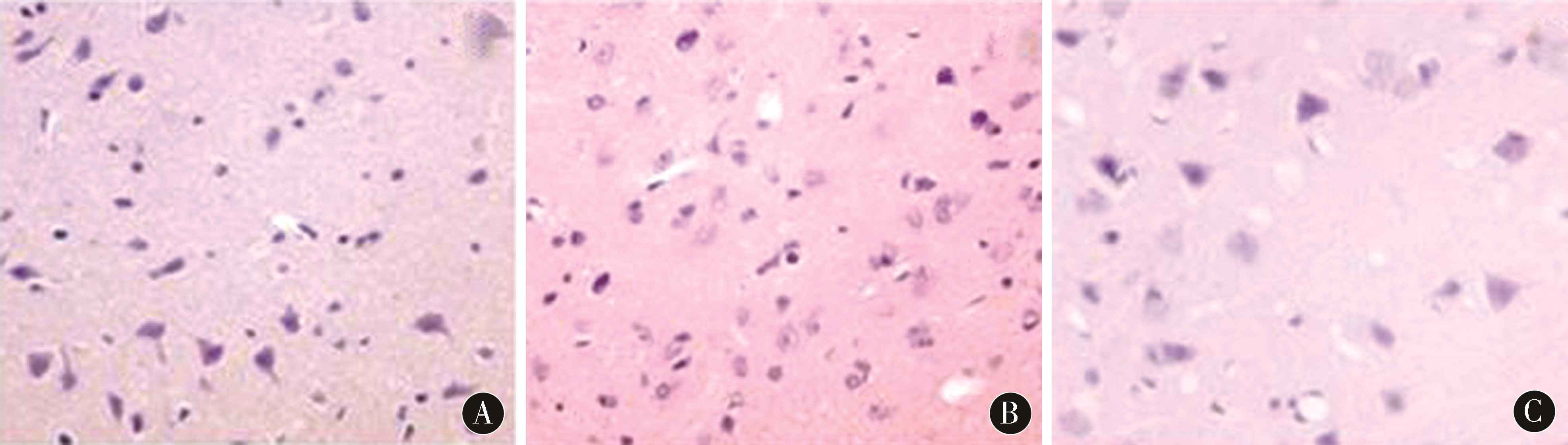
2.3 实验动物HE染色 在光学显微镜下,假手术组动物脑细胞整齐、形状规则;模型组缺血灶脑细胞间隙增宽、胞体缩小、结构模糊、胞质不丰富、核仁不清晰。银杏二萜内酯葡胺组较模型组的病理损害显著减轻(图1)。
表1 造模大鼠的行为学评分
Table1 Behavioral scores of model rats
| 观察指标 |
得分 |
| 完全正常 |
0分 |
| 手术对侧前肢紧贴胸壁、腕肘屈曲、肩内旋、肘外展 |
1分 |
| 向对侧移动时阻力降低, |
2分 |
| 向对侧倾倒, |
3分 |
| 无法自发行走,昏迷 |
4分 |
表2 脑缺血再灌注大鼠神经功能评分 (x±s,n=12)
Table2 Neurological function scores in rats with cerebral ischemia reperfusion (x±s,n=12)
| 组别 |
剂量(mg/kg) |
神经功能评分(分) |
| 48 h |
72 h |
| 假手术组 |
- |
0 |
0 |
| 模型组 |
- |
3.09±0.39△△ |
2.78±0.42△△ |
| 银杏二萜内酯葡胺组 |
50 |
2.15±0.31 |
0.79±0.23* |
注:与假手术组比较,△△P<0.05,与模型组比较,* P<0.01
表3 银杏二萜内酯葡胺组动物GSH、SOD及MDA的变化 (x±s,n=12)
Table 3 Changes of GSH,SOD and MDA in ginkgo diterpene lactone glucuron group (x±s,n=12)
| 组别 |
SOD(U/g Pro) |
GSH(mg/g Pro) |
MDA(mg/g Pro) |
| 假手术组 |
156.21±13.45 |
0.054±0.003 |
1.36±0.21 |
| 模型组 |
96.67±14.43△△ |
0.035±0.006△△ |
1.74±0.26△△ |
| 银杏二萜内酯葡胺组 |
143.32±16.86** |
0.047±0.005** |
1.47±0.32** |
注:与假手术组比较,△P<0.01,△△P<0.05;与模型组比较,P<0.05,**P<0.01
图1 HE染色(×400) A:假手术组;B:模型组;C:银杏二萜内酯葡胺组
Figure 1 HE staining (×400) A:sham operation group;B:model group;C:ginkgo diterpene lactideglucamine group
2.4 大鼠NF-κB含量测定结果 假手术组实验大鼠中NF-κB的表达(0.423±0.22)低于模型组(0.895±0.14),差异具有统计学意义(P<0.01)。模型组大鼠NF-κB的表达高于银杏二萜内酯葡胺组(0.786±0.14),具有显著统计学差异(P<0.01)。
3 讨论
颅内组织由前循环(颈内动脉系统)和后循环(椎-基底动脉系统)双重供血,前后循环由颅底动脉环(willis环)相连,对脑组织血液的调节和代偿具有重要意义[4]。血氧、血糖、血尿酸、血脂、血同型半胱氨酸(homocysteine,Hcy)以及血液黏滞度和凝固性的改变和血液病理状态(红细胞增多症、白血病、异常蛋白血症、血小板增多症等),以及影响心输出量的疾病如心律不齐、房室传导阻滞、心肌损害,亦可使脑局部血流量突然减少成为脑组织一过性缺血的诱发因素。脑微动脉在长期痉挛和高血压的机械性冲击的影响下,可发生纤维性坏死、管腔阻塞,其支配的脑组织可因血液供应被暂时中断而导致脑缺血发作[5-6]。
葡萄糖及酮体是脑组织利用的能量物质,但脑组织本身不含糖原。当脑部供血动脉出现阻塞而无侧支开放代偿时,就会出现相应的缺血病理生理反应,脑细胞开始无氧糖酵解代谢途径,乳酸堆积,形成细胞乳酸酸中毒,进一步影响线粒体膜呼吸链,ATP合成减少,Na-K-ATP酶失活,细胞离子失衡及水分潴留;SOD及GSH活性降低,MDA含量升高,线粒体膜电位降低,Ca2+内流,膜通透性增加,并释放相应的凋亡及炎性因子,引发细胞损害。随着缺血缺氧时间延长,受损的脑细胞内氧自由基及脂质过氧化物不断堆积,损伤膜结构,破坏细胞完整性,释放大量溶解酶,导致脑组织破坏溶解[7-10]。脑内微血管坏死,血管通透性增大,血脑屏障功能进一步破坏,发生血管性脑水肿,加重脑细胞损伤,梗死进展。另有研究显示,脑缺血时NF-κB活化,加速脑细胞死亡,若采用降低其活性的措施则可缩小脑梗死体积[11-14]。脑组织的能量代谢的变化,会引起过度炎症反应,进而影响脑部血流供应,还会直接破坏组织结构。而肿瘤坏死因子及白介素-6等炎性介质的释放会进一步加重血脑屏障的破坏,从而使缺血损伤放大,加重神经功能的损伤。
研究显示,银杏提取物有效成分主要是黄酮和内酯,具有改善微循环、抗氧化、抑制血小板聚集、降血脂、抗衰老、保护血管内皮、促进学习记忆等作用[15-20]。银杏二萜内酯葡胺以银杏叶为原料,经提取纯化后得到其有效部分银杏二萜内酯(银杏内酯A、B、K等),辅料为葡甲胺、柠檬酸、氯化钠[21-23]。银杏二萜内酯葡胺注射液适用于中风病中经络恢复期痰瘀阻络证,具有活血通络之功效,症见瘀血阻络引起的胸痹心痛、中风、半身不遂、舌强语蹇、冠心病稳定型心绞痛、脑梗死等上述症候者[24-28]。
本研究表明,与对照组相比,脑缺血再灌注模型组大鼠脑组织中SOD、GSH含量降低,MDA含量升高,NF-κB含量升高,脑组织HE染色观察脑组织损害明显;银杏二萜内酯葡胺组大鼠脑组织中存在类似改变,但与模型组比较,该组大鼠脑组织中SOD、GSH含量升高,MDA含量降低,NF-κB含量降低,且脑组织HE染色观察脑组织损害较模型组明显减轻;显示了银杏二萜内酯葡胺注射液能降低NF-κB活性,提高SOD、GSH,降低MDA含量,改善氧化应激对神经元及胶质细胞的损伤,降低脑组织的损害,对脑缺血再灌注起到保护作用,从而降低神经损害评分,与其他研究[42-45]一致。
本实验观察到银杏二萜内酯葡胺通过抑制氧化损伤和炎性反应来减少氧化损伤和神经元缺失,说明其具有一定的神经保护作用。
4 参考文献
[1] CEANDELARIO-JALIL E.Injury and repair mechanis-ms in ischemic stroke:considerations for the develop-ment of novel nerotherapeutics[J].Curr Opin Investing Drugs,2009,10(7):644-645.
[2] ChRISTOPHE M,NICOLAS S.Mitoehondria:a target for neuroprotective interventions in cerebral ischemia-reperfusion[J].Curr Pharm Des,2006,12(6):739-740.
[3] LONGA E Z,WEINSTEIN P R,CARLSON S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-85.
[4] Z.VRSELJA,H.BRKIC,S.MRDENOVIC,et al.Function of circle of Willis[J].J Cereb Blood Flow Metab,2014,34(4):578-584.
[5] SANDU RE,DUMBRAVA D,SURUGIU R,et al.Cellular and Molecular Mechanisms Underlying Non-Pharmaceutical Ischemic Stroke Therapy in Aged Subjects[J].Int J Mol Sci,2018,19(1):99.
[6] WONG K S,CAPLAN L R,KIM J S.Stroke Mechan-isms[J].Front Neurol Neurosci,2016,40(15):58-71.
[7] FENG J,CHEN X,GUAN B,et al.Inhibition of Peroxynitrite-Induced Mitophagy Activation Attenuates Cerebral Ischemia-Reperfusion Injury[J].Mol Neurobiol,2018,55(8):6 369-6 386.
[8] CHANG C,ZHAO Y,SONG G,et al.Resveratrol protects hippocampal neurons against cerebral ischemia-reperfusion injury via modulating JAK/ERK/STAT signaling pathway in rats[J].J Neuroimmunol,2018,315:9-14.
[9] ZHAO P,YANG J M,WANG Y S,et al.Neuropro-tection of Cytisine Against Cerebral Ischemia-Reperfusion Injury in Mice by Regulating NR2B-ERK/CREB Signal Pathway[J].Neurochem Res,2018,43(8):1 575-1 586.
[10] LI M,TIAN X,AN R,et al.All-Trans Retinoic Acid Ameliorates the Early Experimental Cerebral Ischemia-Reperfusion Injury in Rats by Inhibiting the Loss of the Blood-Brain Barrier via the JNK/P38MAPK Signaling Pathway[J].Neurochem Res,2018,43(6):1 283-1 296.
[11] LIU T J,ZHANG J C,GAO X Z,et al.Effect of sevoflurane on the ATPase activity of hippocampal neurons in a rat model of cerebral ischemia-reperfusion injury via the cAMP-PKA signaling pathway.[J].Kaohsiung J Med Sci,2018,34(1):22-33.
[12] SHI C X,DING Y B,JIN F Y J,et al.Effects of sevoflurane post-conditioning in cerebral ischemia-reperfusion injury via TLR4/NF-κB pathway in rats[J].Eur Rev Med Pharmacol Sci,2018,22(6):1 770-1 775.
[13] CHU B,ZHOU Y,ZHAI H,et al.The role of microRNA-146a in regulating the expression of IRAK1 in cerebral ischemia-reperfusion injury[J].Can J Physiol Pharmacol,2018,96(6):611-617.
[14] BALAMI J S,WHITE P M,MCMEEKIN P J,et al.Complications of endovascular treatment for acute ischemic stroke:Prevention and management[J].Int J Stroke,2018,13(4):348-361.
[15] BEATRICE BALLARIN,MICHAEL TYMIANSKI.Discovery and development of NA-1 for the treatment of acute ischemicstroke[J].Acta Pharmacologica Sinica,2018,39(3):661-668.
[16] WUFUER A,MIJITI P,ABUDUSALAMU R,et al.Blood pressure and collateral circulation in acute ischemic stroke[J].Herz,2018,20(15):1-5.
[17] CHOIY K,Cho G,HWANG S,et al.Methyleugenol reduces cerebral ischemic injury bysuppression of oxidative injury and inflammation[J].Free Radical Research,2010,44(8):925-935.
[18] HU X,ZHOU X,HE B,XU C,et al.Minocycline protects against myocardial ischemiaand reperfusion injury by inhibiting high mobility group box 1 protein inrats[J].Eur J pharmacol,2010,638(1):84-89.
[19] ZHOUX,WANG H Y,WU B,et al.Ginkgolide K attenuates neuronalinjury after ischemic stroke by inhibiting mitochondrial fission andGSK-3β-dependent increases in mitochondrial membrane permeability[J].Oncotarget,2017,8(27):44 682-44 693.
[20] GENGJ L,AA J Y,FENG S Q,et al.Exploring the neuroprotective effectsof ginkgolides injection in a rodent model of cerebralischemia-reperfusion injury by GC-MS based metabolomic profiling[J].JPharm Biomed Anal,2017,5(142):190-200.
[21] QIN Y,CHEN T.Pharmacokinetics,Metabolism and Disposition of[14C]XQ-1H After Intravenous Administration toMale Rats[J].Drug Metab Lett,2017,10(4):228-239.
[22] WANGS,OUYANG B.Pharmacokinetics and tissuedistribution of ginkgolide A,ginkgolide B,and ginkgolide K after intravenousinfusion of ginkgo diterpene lactones in a rat model[J].JPharm Biomed Anal,2016,15(26):109-116.
[23] FANZY,LIU XG,GUO R Z,et al.Pharmacokineticstudies of ginkgolide K in rat plasma and tissues after intravenousadministration using ultra-high performan-ce liquid chromatography-tandem massspectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2015,15(988):1-7.
[24] ZHOUX W,MA Z,GENG Tet al.Evaluation ofin vitro inhibition and induction of cytochrome P450 activities by hydrolyzedginkgolides[J].J Ethnopharmacol,2014,2(158):132-139.
[25] MA S,LIU X,XUN Q,et al.Neuroprotective effect of GinkgolideK against H2O2-induced PC12 cell cytotoxicity by ameliorating mitochondrialdysfunction and oxidative stress[J].Biol Pharm Bull,2014,37(2):217-225.
[26] GILGUN-SHERKIY,ROSENBAUM Z.Antioxidanttherapy in acute central nervous system injury:current state[J].PharmacolRev,2015,54(2):271-284.
[27] BARBERP A,AUER R N.Understandingand manag-ing ischemic stroke[J].Can J Physiol Pharmacol,2015,79(3):283-296.
[28] LUOY P,ZHANG H,HU H F,et al.Protective effectsof Ginkgo Terpene Lactones Meglumine Injection on focalcerebralischemia in rats[J].Zhongguo Zhong YaoZa Zhi,2017,42(24):4 733-4 737.
(收稿2018-04-03 修回2018-09-05)
本文责编:关慧
本文引用信息:刘新生,王昆,李时光,李艾帆,张瑞锋.银杏二萜内酯葡胺注射液对大鼠脑缺血/再灌注神经保护作用的研究[J].中国实用神经疾病杂志,2018,21(21):2321-2325.DOI:10.12083/SYSJ.2018.21.499
Reference information:LIU Xinsheng,WANG Kun,LI Shiguang,LI Aifan,ZHANG Ruifeng.Protective effects of Ginkgo Terpene Lactones on focal cerebral ischemia/reperfusion injure in rats[J].Chinese Journal of Practical Nervous Diseases,2018,21(21):2321-2325.DOI:10.12083/SYSJ.2018.21.499